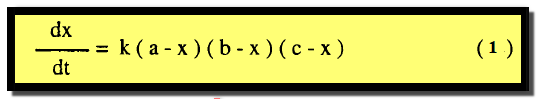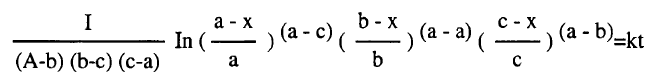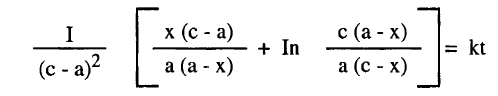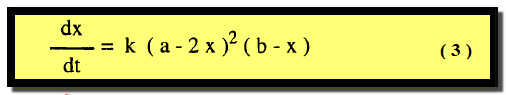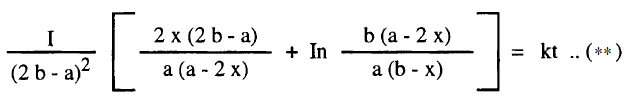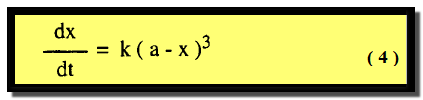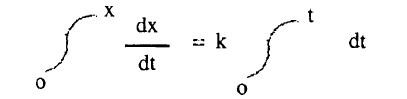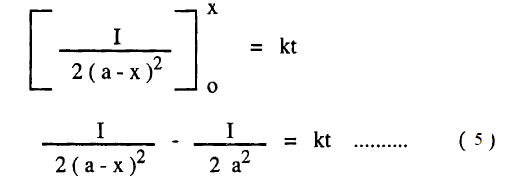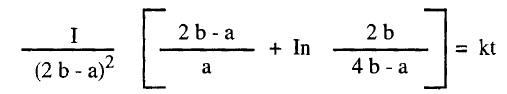تفاعلات الرتبة الثالثة Third Order Reactions
محتويات الموضوع
تعريف تفاعلات الرتبة الثالثة Third Order Reactions
– تفاعلات الرتبة الثالثة هي التفاعلات التي تعتمد فيها سرعة التفاعل على ثلاث تركيزات ويمثل التفاعل بالمعادلة العامة التالية:
A + B + C → Products
– ويوجد ثلاث حالات من هذة التفاعلات كما يلي:
الحالة الأولى
– عندما تكون المواد الثلاثة المتفاعلة في تركيزات أولية مختلفة a , b , c ويمثل التفاعل كما بالمعادلة العامة التالية:
A + B + C → Products
– وإذا كانت الكمية المتفاعلة من كل منهما هي x عند زمن t فإن معادلة السرعة تكون كما يلي:
– والصورة التكاملية لهذه المعادلة معقدة وتعطي في النهاية النتيجة التالية كما يلي:
– وفي الحالة البسيطة عندما يتساوى تركيزان من الثلاثة مثلاً a = b فان المعادلة تصبح كما يلي:
– وتعطي بعد التكامل النتيجة الآتية كما يلي:
الحالة الثانية
– وهى عندما تتفاعل جزئيين من مادة واحدة مع جزئ واحد من مادة أخري وتمثل بالمعادلة العامة كما يلي:
2A + B → Products
– وتكون التركيزات عند أي زمن (a – 2x) ، (b – x) وتصبح معادلة السرعة كما يلي:
– وبإجراء التكامل نحصل على المعادلة الآتية كما يلي:
الحالة الثالثة
– أبسط الحالات عندما تتفاعل ثلاث جزيئات من مادة واحدة وتمثل بالمعادلة العامة:
3A → Products
– وهو نفس التفاعل الأول عندما a = b = c وتصبح معادلة السرعة كما يلي:
– وبإجراءالتكامل بين الحدود كما يلي:
– وهي معادلة السرعة لتفاعل بسيط من الرتبة الثالثة وبرسم العلاقة بين 1/(a-x)2 مع الزمن نحصل على خط مستقيم له ميل يساوي 2k وتقاطع يساوي. 1/a2
وحدات ثابت السرعة لتفاعلات الرتبة الثالثة (K)
– يتضح من المعادلة رقم (5) أن وحدات ثابت السرعة K هي كما يلي:
– أي أن القيمة العددية لثابت السرعة في تفاعل الرتبة الثانية تختلف عن الرتبة الأولى في أنها تعتمد على التركيز والزمن.
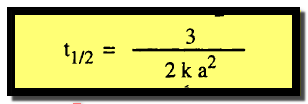
فترة نصف العمر Half Life period
– تعرف فترة نصف العمر لأي تفاعل بأنها (الزمن اللازم لكي ينخفض تركيز المادة المتفاعلة إلى نصف قيمته الأولية) أو (الزمن اللازم لإتمام نصف التفاعل)
– إذا عوضنا فى المعادلة (5) عن قيمة (x) بالقيمة a/2 يمكن الحصول على فترة نصف العمر كما يلي:
– أى انه في تفاعلات الرتبة الثانية تتناسب فترة نصف العمر تناسباً عكسياً مع مربع التركيز الأولى (الابتدائي)
أمثلة لتفاعلات الرتبة الثالثة
(أ) تفاعلات غازية من الرتبة الثالثة
– لا يعرف على وجه التأكيد إلا خمسة تفاعلات غازية متجانسة من الرتبة الثالثة وكلها تتضمن تفاعل أكسيد النيتريك مع أي من الكلور ، البروم ، الأكسجين والهيدروجين أو الديوتيريوم.
– ففي حالة التفاعل مع الهيدروجين مثلاً كما يلي:
2NO + H2 → N2O + H2O
– وفي وجود زيادة من الهيدروجين يعطي ثابت السرعة بالمعادلة (**) أعلاه عند زمن t عندئذ تستهلك نصف كمية اكسيد النيتريك أى أن (2x = a/2) وتصبح المعادلة كالآتي:
(ب) تفاعلات الرتبة الثالثة في المحاليل
– ومن أمثلتها كما يلي:
- أكسدة كبريتات الحديدوز في الماء
- التفاعل بين أيونات اليوديد والحديديك في المحاليل المائية
- التفاعل بين كلوريد البينزويل والكحولات في محلول الأثير
- كذلك تحلل حمض الهيبوبروموز في درجة حموضة ثابتة.
– إقرأ هذة الموضوعات المهمة كما يلي: (أضغط على الموضوع الذي تريده)
(1) رتبة التفاعل Order of reaction
(2) تفاعلات الرتبة الصفرية Zero order reaction
(3) تفاعلات الرتبة الأولي First order reaction
(4) تفاعلات الرتبة الثانية Second order reaction
(5) تفاعلات الرتبـة االثالثة Third order reaction
(6) طرق تعيين رتبة التفاعل Determining of Order reaction
(7) مسائل محلولة على رتبة التفاعل Solved Problems On Order reaction
المراجع : – الكيمياء الحركية والكهربية.محمد مجدي عبد الله واصل. ، الطبعة لأولى (1425هـ – 2004م) / دار النشر للجامعات – القاهرة – جمهورية مصر العربية