تفاعلات الرتبة الصفرية – zero-order reactions
في هذا الموضوع سيتم مناقشة تفاعلات الرتبة الصفرية (zero-order reactions) حيث تم مناقشة تعريف رتبة التفاعل Order of reaction في الموضوع السابق.
دعونا أولاً نتعرف على بعض المفاهيم الهامة قبل الدخول لشرح موضوع اليوم:
 |
| zero-order reactions |
معدل سرعة التفاعل الكيميائي Rate of Reaction
تتفاوت التفاعلات في سرعتها فبعضها:
- تفاعلات سريعة : مثل الانفجارات
- تفاعلات متوسطة : مثل احتراق الوقود
- تفاعـلات بطيئة : مثل صدأ الحديد
تعريف معدل سرعة التفاعل
هو معدل التغير في تركيز المواد المتفاعلة أو الناتجة في وحدة الزمن
ν = dC/dt
حيث يمكن قياس معدل سرعة التفاعل الكيميائي من خلال:
- تحديد مقدار الزيادة في تركيز أحد المواد الناتجة في وحدة الزمن.
- تحديد مقدار الانخفاض في تركيز أحد المواد المتفاعلة في وحدة الزمن.
ملاحظات
- التغير في كميات المواد المتفاعلة يكون دائماً سالب لأنها تتناقص بمرور الزمن.
- التغير في كميات المواد الناتجة يكون دائماً سالب لأنها تزداد بمرور الزمن.
قانون معدل سرعة التفاعل
 |
| قانون معدل سرعة التفاعل |
أما أذا كانت تركيزات المتفاعلات غير متساوية فأن معدل سرعة التفاعل تمثل بالعلاقة الآتية:
 |
| تفاعلات الرتبة الصفرية : zero-order reactions |
المعادلة الحركية العامة
نفترض أن تركيز المادة A = تركيز المادة B
 |
| zero-order reactions |
ومن الصورة السابقة وبما أن معدل سرعة التفاعل يتناسب طردياً مع حاصل ضرب تركيز المتفاعلات فأن:
V = k ( a – x ) ( a – x )
وإذا كان هناك أكثر من مادة متفاعلة فأن القانون يمثل بالعلاقة كما يلي:
V = k ( a – x )n
حيث n تسمى برتبة التفاعل order of reaction
وبما أن سرعة التفاعل هي معدل تغير تركيز المتفاعلات في وحدة الزمن
v = dx/dt
ومن هذه المعادلة و المعادلة السابقة يمكننا استنتاج المعادلة الحركية العامة كما يلي:
dx/dt = k ( a – x )n
ويمكن حل تلك المعادلة بإجراء عملية التكامل بعد وضع قيمة (n)
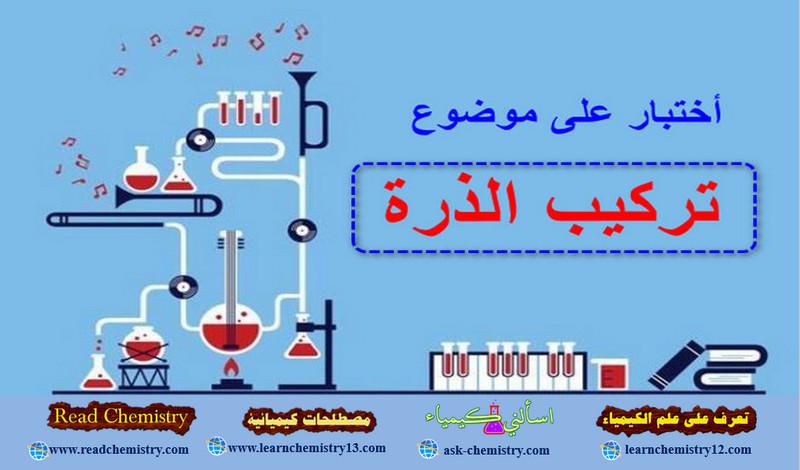
تفاعلات الرتبة الصفرية zero-order reactions
وهى التفاعلات التي لا تعتمد سرعتها على تركيز المواد المتفاعلة حيث n = 0 وبالتعويض في المعادلة السابقة نحصل على هذه المعادلة كما يلي:
dx/dt = K
 |
| zero-order reactions |
وبإجراء التكامل للمعادلة السابقة نحصل على معادلة الرتبة الصفرية كما يلي:
X = k t
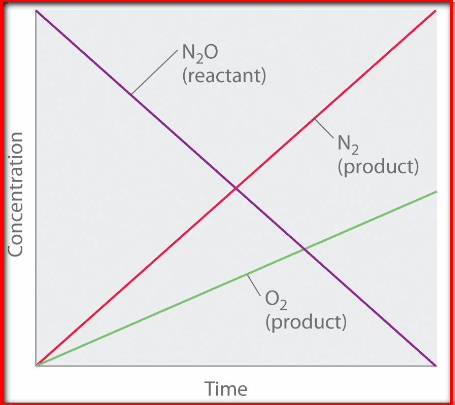
ومن التمثيل البياني للعلاقة بين التركيز والزمن في تفاعلات الرتبة الصفرية نجد ان الميل = k ثابت سرعة التفاعل كما بالصورة:
 |
| zero-order reactions |
من معادلة الرتبة الصفرية يمكننا استنتاج وحدة قياس ثابت معدل التفاعل K وتكون: mole/L . t-1 ( وحدة تركيز / وحدة الزمن )
حساب زمن نصف عمر التفاعل Half-life time t1/2 لتفاعلات الرتبة الصفرية
وكما هو واضح فأن زمن نصف عمر التفاعل يزداد بزيادة التركيز الابتدائي للمادة المتفاعلة ( a )
أمثلة على تفاعلات الرتبة الصفرية
(1) التحلل الضوئي لغاز الكلور Photolysis of Chlorine gas
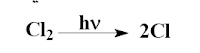
حيث لا تعتمد سرعة التحلل على ضغط الغاز ( تركيزه) ولكن تعتمد على عوامل أخري من كمية الضوء والطول الموجي له وعلى درجة الحرارة.
(2) تفكك غاز أكسيد النيتروز Decomposition of NO2
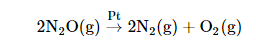
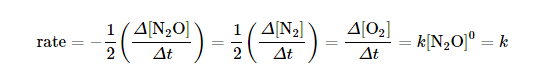
 |
| zero-order reactions |
حيث لا تعتمد سرعة التفكك على ضغط الغاز ( تركيزه) ولكن تعتمد على عوامل أخري مثل وجود العامل الحفاز ( البلاتين ) وعلى درجة الحرارة.
7- مسائل محلولة على رتبة التفاعل Solved Problems On Order reaction