قوى التجاذب بين ثنائيات الأقطاب Dipole-Dipole Attractive Forces
أنواع قوى التجاذب بين الجزيئات Types of Intermolecular Attractive Forces
– في هذا الموضوع سيتم مناقشة قوى التجاذب بين ثنائيات الأقطاب Dipole-Dipole Attractive Forces. وهي أحد أنواع قوى التجاذب بين الجزيئات.
– هناك قوى تجاذب بين جزئيات السائل ، وهذه القوى أضعف بكثير من الرابطة التساهمية التي تربط بین الذرات في الجزيء، فمثلاً الطاقة اللازمة لتبخير السائل ( إبعاد الجزيئات بعضها عن بعض) أقل بكثير من الطاقة اللازمة لتكسير الروابط في جزيئات السائل.
– وإليكم أنواع قوى التجاذب بين الجزيئات:
(1) قوى ثنائي القطب – ثنائي القطب Dipole-Dipole Attractive Forces
(2) قوى التجاذب بين أيون وجزيء ثنائي القطب Ion-Dipole AttractiveForces
(3) قوى التجاذب بين أيون وجزيء قطبي مستحث Ion-Induced DipoleAttractive Forces
(4) الرابطة الهيدروجينية Hydrogen Bond
(5) قوى لندن التشتتية LondonDispersion Forces ( قوى فان درفالز)
قوى التجاذب بين ثنائيات الأقطاب Dipole-Dipole Attractive Forces
– وھي قوى تجاذب تنشأ بین الجزیئات القطبیة مثل: كلورید الھیدروجین (HCl) ، برومید الھیدروجین (HBr) ، كلورید الیود (ICl) ، الكلوروفورم (CH3Cl) ، ثنائي كلورید المیثان CH2Cl2.
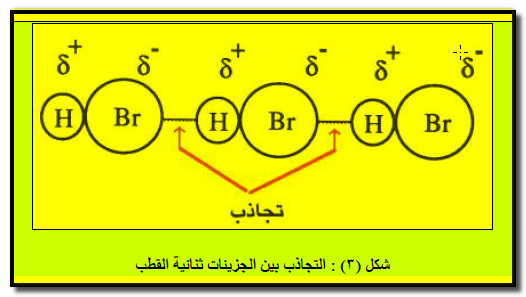
– حیث تنظم ھذه الجزیئات نفسھا، بحیث یقترب القطب الموجب لجزيء من القطب السالب في جزيء آخر كما یظھر من الشكل (٣) كما يلي:
– تتخذ النھایات المختلفة للأقطاب أوضاعاً متقابلة مما یؤدي إلى تجاذبھا.
– ومن أھم العوامل المؤثرة على قوى التجاذب بین ثنائیات الأقطاب: طریقة توجیه هذه الأقطاب.
– وتمیل الجزیئات ثنائیة القطب إلى أن ترتب نفسھا، بحیث أن الشحنة الموجبة الجزئیة على أحدھا تكون بقرب الشحنة السالبة الجزئية على الجزیئات الأخرى.
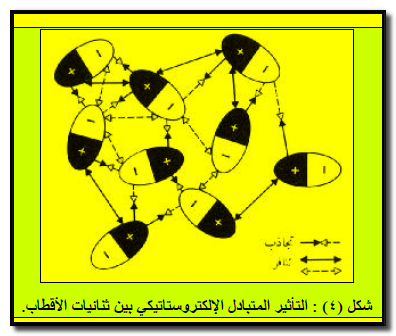
– وبما أن الجزیئات في حركة وتصادم مستمرین مع بعضھا بعضاً، فأن ھذا الوصف یكون بعیداً عن الكمال، خاصة في السوائل والغازات، ومع ذلك، یرجح التجاذب بین الأطراف المشحونة بشحنات متعاكسة للجزیئات ثنائیة القطب على التنافر بين الأطراف المتماثلة الشحنة، فیتواجد نتیجة ذلك تجاذب إجمالي صافي بینھا ( شكل ٤) .
مقارنة بين التجاذبات ثنائيات الأقطاب والروابط الأيونية أو الروابط التساهمية
التجاذبات بین الجزيئات ثنائية أضعف بكثير عادةً من الروابط الأيونية أو التساهمية. فهي حوالي (%1) فقط من قوتها. وشدتها تتناقص بسرعة كبيرة كلما ازدادت المسافة بین ثنائيات الأقطاب. وهكذا فإن تأثيراتها بین جزئيات الغاز الشديدة التباعد أقل بكثير مما هي علية بين الجزئيات المرصوصة بإحكام في السوائل أو المواد الصلبة. وهذا هو سبب تصرف جزئيات الغاز وكأنما ليس بينها قوى تجاذب على الإطلاق.
مقارنة بین الحالتين الصلبة والسائلة من جھة أوضاع الجزيئات ثنائیات الأقطاب
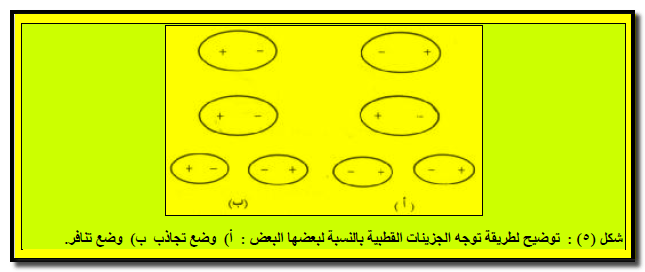
وبالمقارنة بین الحالتين الصلبة والسائلة من جھة أوضاع الجزیئات ثنائیة القطب فإنه:
– في الحالة الصلبة : یتم ذلك بحیث تكون قوى التجاذب كبیرة جدا (شكل ٥ أ)
– أما في الحالة السائلة وبسبب قدرة الجزئيات على الحركة المستمرة فإن الذي يحدث هو اتخاذ الأقطاب مرات لأوضاع متجاذبة ومرات أخري لأوضاع متنافرة (شكل ٥ ب) .
– ولكن وجد أن الحاصل النھائي ھو حدوث تجاذب فیما بین الأقطاب بمعدل أعلى من التنافر .
– ولقد وجد أن ذلك یتناسب طردیاً مع مربع العزم القطبي لكل قطب (μ2 ) وعكسیاً مع القوة السادسة للمسافة الفاصلة بین مركزي القطبین (d6) كما فى المعادلة التالية:
س: ما تأثير ازدیاد المسافة على هذه القوى؟
ج- من العلاقة :
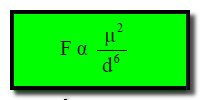
فأن تأثير هذه القوي يتلاشى تدريجياً بازدياد المسافة. ولا يكون أثره هاماً إلا في الحالات التي تكون فيها الجزئيات متقاربة من بعضها البعض .المراجع: أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية.