الروابط الهيدروجينية Hydrogen Bonds
– هناك قوى تجاذب بين جزئيات السائل ، وهذه القوى أضعف بكثير من الرابطة التساھمیة التي تربط بین الذرات في الجزيء، فمثلاً الطاقة اللازمة لتبخیر السائل ( إبعاد الجزیئات بعضھا عن بعض) أقل بكثیر من الطاقة اللازمة لتكسیر الروابط في جزیئات السائل، ولكن في هذا الدرس سوف نشرح الروابط الهيدروجينية Hydrogen Bonds
محتويات الموضوع
أنواع قوى التجاذب بين الجزيئات Types of Intermolecular Attractive Forces
(1) قوى ثنائي القطب – ثنائي القطب Dipole-Dipole Attractive Forces
(2) قوى التجاذب بين أيون وجزيء ثنائي القطب Ion-Dipole AttractiveForces
(3) قوى التجاذب بين أيون وجزيء قطبي مستحث Ion-Induced DipoleAttractive Forces
(4) الرابطة الهيدروجينية Hydrogen Bond
(5) قوى لندن التشتتية LondonDispersion Forces ( قوى فان درفالز)
– وكنا قد شرحنا في الموضوعات السابقة كل نوع على حدا بطريقة مفصلة (اضغط على الموضوع الذى تريد قرأته ليتم تحويلك إلى الموضوع) ولكن في هذا الدرس سوف نشرح الروابط الهيدروجينية Hydrogen Bonds
تعریف الروابط الهيدروجينية Hydrogen Bond
– تنشأ الرابطة الھیدروجینیة بین الجزیئات ثنائیة القطب بشكل خاص عندما ترتبط ذرة الھیدروجین تساھمیاً مع عنصر صغیر جداً ذي سالبیة كھربیة عالیة مثل :الفلور، الأكسجین، النیتروجین.
– ففي ھذه الحالات التي تنتج جزیئات عالیة القطبیة للغایة. حیث تحمل ذرة الھیدروجین الصغیرة كمیة لا بأس بھا من الشحنة الموجبة.
– وبما أن النھایة الموجبة لثنائي القطب بإمكانھا الاقتراب عن كثب من النھایة السالبة لثنائي قطب مجاورة ، فقوة التجاذب بین النھایتین كبیرة إلى حد ما.
– ویدعى ھذا النوع الخاص من التجاذب ثنائي القطب بالرابطة الھیدروجینیة (Hydrogen Bond) وتعادل حوالي % 5 إلى % 10 من قوة الرابطة التساھمیة العادیة.
– والرابطة الھیدروجینیة ھي إحدى أنواع القوى القطبیة (رابطة فیزیائیة) بل أكثر قوة منها.
– ومما سبق فإنها تنشا نتيجة فرق كبير في السالبية الكهربية بين ذرة الهيدروجين ( ذي السالبية الكهربية 2.2) في جزئ (المرتبطة أصلاً بذرة أكسجين أو نتيروجين أو فلور) وذرة عنصر آخر مثيل لها سالبية كهربية عالية مثل: (N = 3, O = 3.5, F =4).
– ویتم تكوین ھذه الرابطة من خلال زوج الإلكترون الحر الموجود علي الأكسجين أو الفلور أو النيتروجين التي تنتمي للجزئ الآخر المثيل. وبسبب أن الفرق في السالبیة كبیر فتتكون رابطة قویة.
– ولا یحدث الترابط الھیدروجیني إلا في وجود ذرات الهيدروجين فقط (علل)، ذلك لأن للذرات الأخرى أغلفة الیكترونیة تحجب أنویتھا عن ذلك الترابط.
– لهذا نجد أن الرباط الهيدروجيني لا يحدث إلا مع المركبات التي تحتوي على الهيدروجين دون غيرها.
أسئلة محلولة على الروابط الهيدروجينية Hydrogen Bond
سؤال (1)
ما تأثیر الفرق في السالبیة الكھربیة بین الھیدروجین والذرات (F, N, O)؟
الإجابة:
– هذا الفرق كاف لإحداث استقطاب في الجزئ (بمعنى نشوء نهايتين أحدهما موجبة والأخرى سالبة).
سؤال (2)
كیف یحدث ھذا الاستقطاب؟
الإجابة:
– يحدث استقطاب الجزئ نتيجة لانحياز الإلكترونات الرابطة بين الذرتين نحو الذرة الأعلى سالبية كهربية مما يجعل السحابة الإلكترونية حولها ذات كثافة أعلى منها حول ذرة الهيدروجين فيصبح الجزئ عبارة عن قطب يكون الهيدروجين نهايته الموجبة.

سؤال (3)
ماذا ینتج عن نشوء الجزیئات القطبیة السابقة؟
الإجابة:
– ینشأ قوى تجاذب بین ھذه الجزئيات القطبية من نوع قوي التجاذب بين جزئ ثنائي القطب وآخر ثنائي القطب، حیث تتجاذب الجزیئات عبر نھایاتھا القطبیة كما يلي:
– كما إن وجود الرابطة الهيدروجينية بين الجزئيات يؤدي إلى زيادة تجاذبها مع بعضها البعض وبالتالي یزید من درجة غلیانھا ویقلل من ضغطھا البخاري.
– وكلما زاد عدد الروابط الهيدروجينية بين الجزئيات فإن ذلك يؤدي إلى زيادة تجاذبھا مع بعضھا البعض وبالتالي یزید من درجة غلیانھا.
سؤال (4)
لماذا درجة غلیان الماء (H2O (100 °C أعلى من النشادر (NH3 (-33 °C؟
الإجابة:
– ذلك أن عدد الروابط الھیدروجینیة في الماء أعلى منھا في النشادر.
سؤال (5)
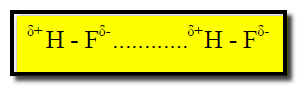
لماذا درجة غلیان فلورید الھیدروجین (HF (17 °C أعلى من درجة غليان بروميد الهيدروجين (HBr (– 70 °C؟
الإجابة:
– السبب ھو وجود الرابطة الھیدروجینیة بین جزیئات فلورید الھیدروجین كما يتضح من الشكل التالي:
– بینما لا توجد ھذه الروابط الھیدروجینیة بین جزیئات برومید الھیدروجین (HBr).
سؤال (6)
لماذا درجة غليان الماء (H2O (100°C أعلى من درجة غليان كبريتيد الهيدروجين (H2S (- 61 °C؟
الإجابة:
– لوجود روابط هيدروجينية بين جزئيات الماء (H2O).
– بينما لا توجد هذه الروابط الهيدروجينية بين جزئيات كبريتيد الهيدروجين (H2S).
سؤال (7)
لماذا لا توجد روابط هيدروجينية بين جزئيات الإيثر الميثيلي (H3C-O- CH3)؟
الإجابة:
– وذلك لعدم وجود ذرة ھیدروجین مرتبطة بذرة ذات سالبیة كھربیة مرتفعة مثل .(F, N, O)
سؤال (8)
لماذا هل يمكن للرابطة الهيدروجينية أن تتكون إذا استبدلنا (N, O, F) بذرة كبريت (S) أو كلور(Cl) أو بروم (Br) ؟ لماذا؟
الإجابة:
– لا تنشأ الرابطة الھیدروجینیة إذا استبدلنا ذرة الأكسجین أو النیتروجین أو الفلور بأي ذرة أخرى كذرة الكبریت (S) أو البروم (Br) أو الكلور (Cl)على الرغم من أن كهروسالبیتھا عالیة كالسابقات.
– وذلك لأن ذرة الهيدروجين صغيرة جداً ویناسب صغرھا ھذا صغر ذرات الأكسجین والنیتروجین والفلور.
أهمية الروابط الهيدروجينية
– الرابطة الھیدروجینیة هي أحد أنواع قوي التجاذب الضعيفة ذات الأهمية الكبيرة.
– ففي الماء مثلاً تؤثر الجزیئات بقوة على بعضھا البعض بواسطة الرباط الھیدروجیني (شكل ٧).
– وینتج عن ھذا قوى تجاذب أقوى بكثیر من تلك التي بین جزیئات أخرى مماثلة لھا في الحجم والكتلة، وھي التي تجعل الماء سائلاً عند درجة حرارة الغرفة.
– الرباط الهيدروجيني مسئول أيضاً فى التحكم فى توجيه جزئيات الماء فى حالة الجليد حيث يوجد كل جزئ من جزئيات الماء محاطاً بأربعة جزئيات أخري ومرتبطاً معها بواسطة روابط هيدروجينية.
– وسبب هذا في امتلاك الجلید لبنیة (مفتوحة) للغایة، وفي جعل الجلید أقل كثافة من الماء السائل حیث یطفو فوقه.
– ولھذا السبب تطفو المكعبات والجبال الجلیدیة (وھذا ھو السبب في الكارثة التي حلت بسفینة الركاب تیتانك Titanic التي غرقت إثر اصطدامھا بجبل جلیدي).
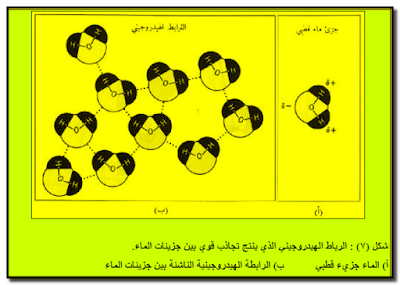
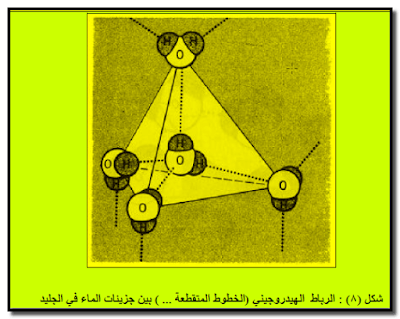
تأثير الرابطة الهيدروجينية على صفات الماء
– ینتج عن الرابطة الھیدروجینیة في الماء قوى تجاذب أقوى بكثير من تلك التى بین جزیئات أخرى مماثلة لھا في الحجم والكتلة.
– بسبب الروابط الهيدروجينية نجد أن الماء له درجة غليان عالية حيث تبلغ الحرارة النوعية المكتسبة للتبخير(2257J/g).
– علاوة على ذلك فأن الروابط الھیدروجینیة بین جزیئات الماء ھي التي تجعل الماء سائلاً عند درجة حرارة الغرفة.
– تفسر قوة هذه الرابطة صغر المسافة التى تربط بين ذرات الهيدروجين والأكسجین مما ینتج عنه انخفاض ملحوظ في كثافة الماء عند درجة التجمد .
– الترابط الهيدروجيني مسئول أيضا عن التحكم في توجيه جزئيات الماء في الجليد كما سبقت الإشارة إليه.
أمثلة على الروابط الهيدروجينية
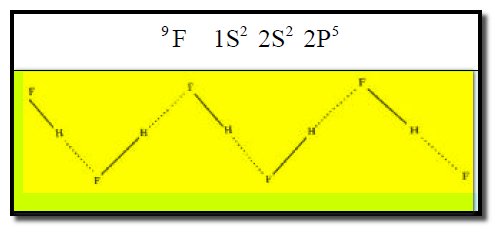
(1) الروابط الهيدروجينية في جزيء فلورید الھیدروجین HF
– تظھر جزیئات فلورید الھیدروجین HF على هيئة خطوط متعرجة.
– يوجد على ذرة الفلور المرتبطة بالهيدروجين ثلاثة أزواج الكترونية حرة وبالتالي فإنه يمكن لذرة الفلور عمل رابطة هيدروجينية مع ذرة هيدروجين جزئ آخر من (HF) في أي اتجاه.
– لھذا السبب تظھر جزیئات (HF)على هيئة خطوط متعرجة .(zigzag) كما يلي:
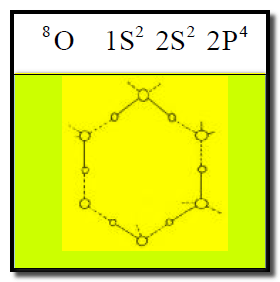
(2) الروابط الهيدروجينية في جزيء الماء H2O
– تظهر جزیئات الماء على ھیئة شبكة.
– نظراً لوجود زوجین الكترونیین حرین في ذرة الأكسجین المرتبطة بالھیدروجین فإنه یمكن لذرة الأكسجین عمل رابطة هيدروجينية مع ذرة هيدروجين جزئ آخر(H2O) فى أي اتجاه من هذين الاتجاهين.
– لهذا السبب تظهر جزئيات الماء على هيئة شبكة كما يلي:
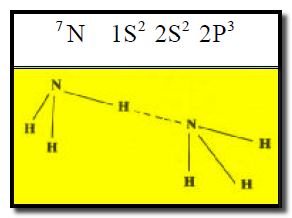
(3) الروابط الهيدروجينية في جزيء النشادر NH3
– تظھر جزیئات النشادر على ھیئة تفرعات.
– نظراً لوجود زوج الكتروني حر في ذرة النیتروجین المرتبطة بالھیدروجین فإنه لا یمكن لذرة النیتروجین عمل رابطة ھیدروجینیة مع ذرة ھیدروجین جزيء آخر إلا في اتجاه واحد.
– لھذا السبب تظھر جزیئات النشادر على ھیئة تفرعات كما يلي:
(4) الروابط الهيدروجينية في بعض المركبات العضویة
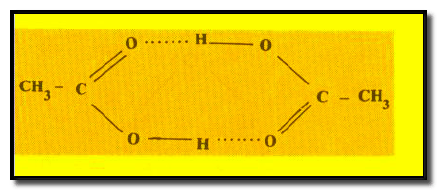
– الرابطة الهيدروجينية في حمض الخل CH3COOH كما يلي:
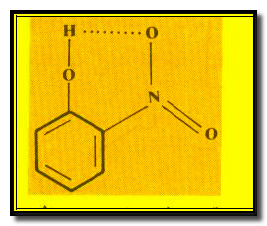
– تظهر الرابطة الهيدروجينية في مركب أورثونیتروفینول O-Nitrophenol في نفس الجزيء كما يلي:
المراجع: أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية.