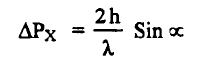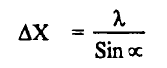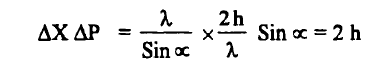مبدأ عدم التأكد لهايزنبرج Heisenberg Uncertainty Principle
مبدأ عدم التأكد لهايزنبرج
– ينص لمبدأ عدم التأكد لهايزنبرج على أنه ( ليس من الممكن في آن واحد وبدقة تحديد كلا من سرعة ومكان الإلكترون).
– وهذا يعني أنه يمكن أن نقيس وبدقة سرعة الإلكترون ولكن على حساب عدم التأكد من الموضع له أو العكس.
– ونحن لا نعتقد أن الإلكترون عندما يتحرك دائرياً من مكان إلى مكان أو من نقطة إلى نقطة يأخذ تحرك معلوم أو مثبت عن كل نقطة.
استنباط فكرة مبدأ عدم التأكد لهايزنبرج
– يبرهن الانحراف الحادث للإلكترون بواسطة البلورات في تجربة دافيسون وجيرمر Davisonand Germer ( أن الإلكترون له صفات الموجة).
– هذه النتيجة كانت مباشرة تعارض بعض التجارب الأخرى وخصوصاً التي حصل عليها طومسون (J.J.Thomson). والتي تنص على (أن الإلكترون هو عبارة عن كتلة وطاقة أو له كتله وطاقة).
– ولكي نتوصل إلى الوفاق بين التصور في الإلكترون على أنه موجه مع الوصف للإلكترون أنه جسيم. فقد اقترح بور أساس التكامل ، فيما بين ذلك على أن الإلكترون لا يأخذ كلاً من الوصف الموجي أو الوصف الجسيم في وقت واحد أو على الدوام.
– ولكن كلا التصورين مكمل لأحدهما الآخر في وصف الإلكترون وبالتالي فقد أعلن هايزنبرج من مفهوم هذا النقاش وأعلن مبدأ عدم التأكد عام 1927.
تجربة فعلية لتوضيح مبدأ عدم التأكد لهايزنبرج
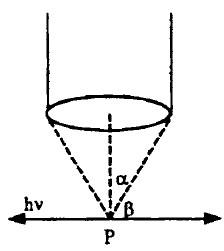
– ولنفترض هذه التجربة القائمة على الافتراض والتي تسوقنا لقياس الوضع والسرعة معاَ في آن واحد ، حيث يبين الشكل مثل هذا التنسيق كما يلي:
– حيث تستخدم ميكروسكوب إلكتروني ذو ضوء عال جداً قوي التحليل. فلو أنه يوجد منبع ضوء (أشعة جاما وأشعة X) مثلاً لها طاقة (hν) تصطدم بالإلكترون عند الموضع (P)
– وعندما يشتت الإلكترون مثل هذا الضوء (الفوتونات) إلى الميكروسكوب تحدث زاوية (B) مع المحور (X) فإن الإلكترون سيختزن بعض من هذه الحركة من الفوتون على طول المحور (X).
– وبالتالي فإن الضوء المشتت يمكن أن يدخل إلى الميكروسكوب من أي مكان خلال فتحة القمع بزاوية (2X).
– هذه المساهمة للمحور (X) لحركة الإلكترون الغير معلومة بالمقدار.
حيث ΔPx تعرف بعدم التأكد لحركة الإلكترون .
ولتعيين تحديد المكان بواسطة الميكروسكوب كما هو موضح بمعادلة ريليغ Rayleigh equation لتحليل الضوء.
حيث أن ΔX عدم التأكد في موقع الجسيم على المحور (X) ، والمحور يحدد موضع الإلكترون ، λ طول الموجة للفوتون. وناتج عدم التأكد في تحديد الموضع والحركة في آن واحد للإلكترون هي :
وعلى العموم فأن ناتج حاصل ضرب عدم التأكد لموقع وعزم الجسيم (ΔX.ΔP) ما هو إلا قيمة لثابت بلانك h (كمية محددة).
– وبالرغم من أننا قمنا بتحليل تجربة واحدة . إلا أنه لوحظ أن تحليل تجارب عديدة آخري تؤدي إلى نفس النتيجة. وهي أن حاصل ضرب اللادقة في X , Px لجسيم هو مقارب لمقدار ثابت بلانك أو أكبر منه . أي أن :
ΔPx . ΔX ≥ h
وهذا هو مبدأ اللادقة الذي أكتشفه هايزنبرج عام 1927.
ملاحظات هامة
ومجموعة أخرى من المتغيرات يمكن أن تستخدم للتعبير لمبدأ عدم التأكد لو أن (E) تكون طاقة النظام عند زمن (t) يمكن أن نرى هذه المعادلة كما يلي:
ΔE . Δt ≥ h
حيث ΔE عدم التأكد في معلومية لقيمة الطاقة على حساب الزمن ، Δt عدم التأكد في معلومية الزمن على حساب الطاقة.
ولنا أن نسأل أين يكون الإلكترون حول النواة ؟ ولكن لنا فقط أن نتكلم حول احتمال وجوده حول النواة ، ربما يكون عند مسافات مختلفة من النواة في عدة مواضع 1،2،3 انجستروم وحتى 100 انجستروم من النواة ، هذه الاحتمالات تأخذ قيم محددة.
الخلاصة
ينص مبدأ اللادقة لهايزنبرج على:
(أنه يستحيل عملياً في آن واحد تحديد سرعة ومكان دقيقة متناهية في الصغر (الإلكترون) ولكن التحدث بلغة الاحتمالات هو الأقرب للصواب).
– بتطبيق هذا المبدأ على ذرة الهيدروجين، نجد أنه غير مناسب تصور أن الإلكترون يدور حول النواة في مدار محدد.
المراجع :
– مبادئ كيمياء الكم. محمد مجدي واصل ،الطبعة الأولي (2008) / دار النشر للجامعات – القاهرة – جمهورية مصر العربية
– أساسيات الكيمياء الفيزيائية. عبد العليم سليمان أبو المجد – فاطمة حافظ كمال محمد ، الطبعة لأولى (1426هـ – 2005م) / دار النشر للجامعات – القاهرة – جمهورية مصر العربية