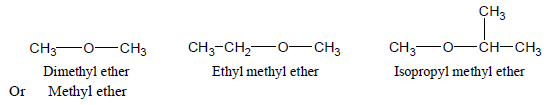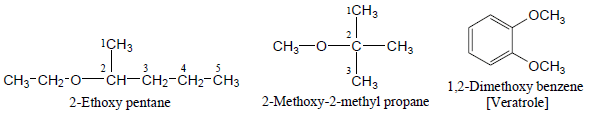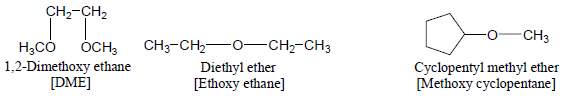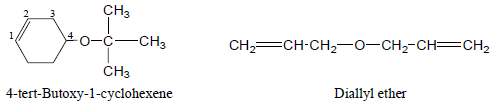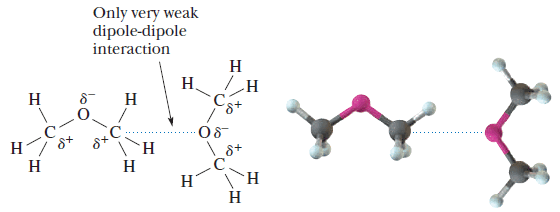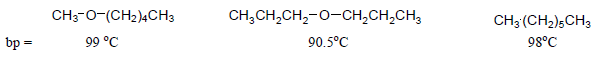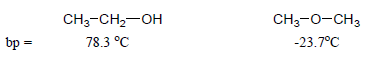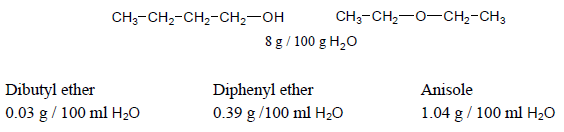تعريف الإيثرات
– الإيثرات هي مركبات عضوية تتميز جزيئاتها بارتباط ذرة الأكسجين بذرتي كربون مكونة ما يسمى بالرابطة الإيثيرية C-O-C
تسمية الإيثرات Nomenclature of ethers
(1) تسمية الايثرات البسيطة
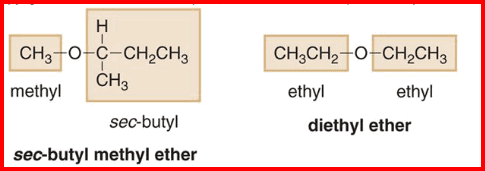
– تسمى الإيثرات البسيطة Simple ethers عن طريق تسمية المجموعتين العضويتين المتصلتين بذرة الأكسجين ثم تتبع بكلمة إيثر ether
– أمثلة للايثرات البسيطة كما يلي:
(2) تسمية الإيثرات المعقدة
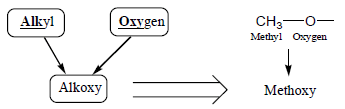
– إما عند تسمية الإيثرات المعقدة التركيب أو التي بها أكثر من رابطة إيثيرية فتسمى كمشتقات Alkoxy
– – أمثلة للايثرات المعقدة كما يلي:
تصنيف الإيثرات Classification of ethers
تصنف الإيثرات على حسب المجموعات العضوية المتصلة بذرة الأكسجين إلى أربعة أقسام كما يلي:
(1) إيثرات أليفاتية Aliphatic Ethers
– وهي التي تتصل فيها ذرة الأكسجين بمجموعتى ألكيل كما يلي:
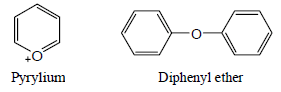
(2) ايثرات أروماتية Aromatic Ethers
– وتتصل فيها ذرة الأكسجين بمجموعتى آريل أو تكون إيثرات حلقية كما يلي:
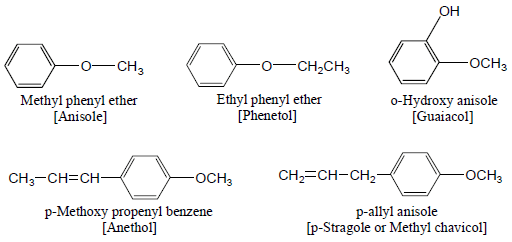
(3) ايثرات مختطلة Mixed Ethers
– وتتصل فيها ذرة الأكسجين بمجموعة آريل ومجموعة ألكيل كما يلي:
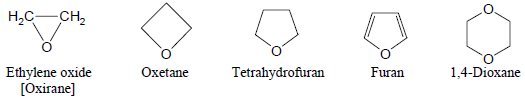
(4) ايثرات حلقية Heterocyclic Ethers
– وتكون فيها الرابطة الإيثرية جزء من الحلقة كما يلي:
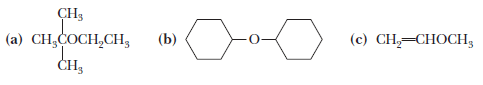
تمارين على تسمية الايثرات
تمرين: سمى المركبات الأتية حسب التسمية الشائعة Common name وحسب تسمية الأيوباك IUPAC name
:answer
(a) 2-Ethoxy-2-methylpropane. Its common name is tert-butyl ethyl ether.
(b) Cyclohexoxycyclohexane. Its common name is dicyclohexyl ether.
(c) Methoxyethene. Its common name is methyl vinyl ether.
الخواص الفيزيائية للأيثرات Physical properties of ethers
(1) درجة غليان الإيثرات Boiling point of ethers
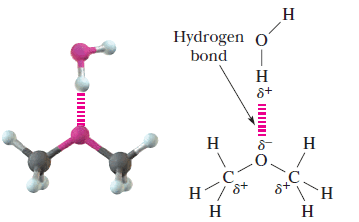
– الإيثرات مركبات قطبية حيث تحمل ذرة الأكسجين شحنة موجبة جزئية وتحمل كلاً من ذرتى الكربون شحنة سالبة جزئية لذلك توجد فقط قوى ضعيفة ترتبط الجزئيات ببعضها تسمى dipole – dipole interaction
– علاوة على ذلك فأن للايثرات درجات غليان منخفضة نظراً لعدم مقدرتها على تكوين روابط هيدروجينية بين جزئياتها حيث لا توجد ذرة هيدروجين مرتبطة بذرة الأكسجين.
– وبمقارنة درجات غليانها مع درجات غليان الألكانات المقابلة لها في الوزن الجزيئي نجد أن لها درجات غليان أعلى وذلك بسبب قطبية جزيئاتها كما يلي:
– بالإضافة إلى ذلك تتأثر قطبية الإيثرات بطول السلسلة الهيدروكربونية حيث كلما ازداد طول السلسة كلما قلت قطبية جزئ الإيثر وبالتالي تقترب درجات غليانها من درجات غليان الألكانات المقابلة لها في الوزن الجزيئي.
– درجات غليان الإيثرات أقل من درجة غليان الكحولات المقابلة لها في الوزن الجزيئي وذلك لمقدرة الكحولات على تكوين روابط هيدروجينية بين جزيئاتها.
(2) ذوبانية الايثرات Solubility of ethers
– للايثرات ذوبانية منخفضة في الماء حيث أنها تكون روابط هيدروجينية ضعيفة جداً مع هيدروجين الماء نظراً لحجم مجموعات الألكيل التي تعيق ارتباط ذرة الأكسجين بذرة الهيدروجين.
– فمثلاً نجد أن أعلى الإيثرات الأليفاتية ذوبانية هوDimethyle ether حيث يذوب كل 37 جحم منه في حجم واحد من الماء وذلك بسبب صغر مجموعة الميثيل وذوبانية Diethyle ether والمتشكل الكحولي 1- Butanol هي نفسها تقريباً.
– وللايثرات الحلقية المشبعة ذوبانية عالية جداً في الماء حيث يمتزج كل من الدايوكسان و THF بأي نسبة مع الماء.
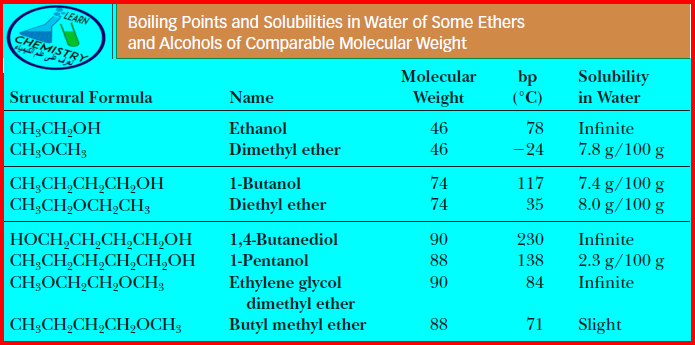
– الجدول التالي يوضح درجة الغليان والذوبانية لبعض الإيثرات ومقارنتها بالكحولات التى لها نفس الوزن الجزئيئ كما يلي:
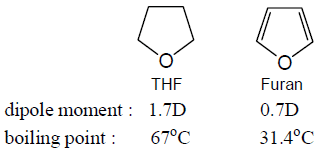
تمرين:Furan إيثر غير مشبع ،THF إيثر مشبع ، فكيف يمكن تفسير قيم العزم القطبي ودرجتى الغليان لكلاً منهما؟
الحل: يرجع انخفاض قيمة العزم القطبي للـ Furan رغم احتوائه على إلكترونات π للرنين داخل الحلقة الذي يجعل الشحنة غير متمركزة على ذرة الاكسجين عكس THF الذي تكون فية إلكترونات (σ) مشدودة تجاه ذرة الأكسجين ذات الكهروسالبية العالية وبالتالي يكون جزئ THF أعلى قطبية وأعلى درجة غليان.
المراجع:
- أسس الكيمياء العضوية . وائل غالب محمد – وليد محمد السعيطي ، الطبعة الأولى (2008) / دار الكتب الوطنية – بنغازي – لبيبا
- Organic chemistry / William H. Brown , Christopher S. Foote , Brent L. Iverson , Eric V. Anslyn , Bruce M. Novak . ( sixth edition ) . United States\
موضوعات ذات صلة بالإيثرات كما يلي:
 تعرف على علم الكيمياء
تعرف على علم الكيمياء