السرعات الجزیئیة للغازات: توزيع ماكسويل- بولتزمان
فى هذا الموضوع سنقوم بشرح السرعات الجزیئیة للغازات – توزيع ماكسويل وبولتزمان Maxwell and Boltzman Distribution
مقدمة عن السرعات الجزيئية
– في البداية يمكنك قراءة شرح كامل عن السرعات الجزيئية Molecular Speed
– تسمح لنا نظریة الحركة الجزیئیة للغازات بفحص الحركة الجزیئیة وبتفاصیل دقیقة.
– إفترض أن لدینا عدداً كبیراً من جزیئات الغاز في إناء. إننا نتوقع أن تكون حركة الجزیئات عشوائیة بالكامل كما أنه لا یمكن التنبؤ بھا. كلما ظلت درجة الحرارة ثابتة فإن متوسط طاقة الحركة ومتوسط السرعة الجزیئیة سوف یظلان ثابتین مع مرورالزمن.
– والمیزة الجدیرة بالإھتمام ھنا ھي انتشار أو توزیع السرعات الجزیئیة. فعند اللحظة المعینة ما ھو عدد الجزیئات التي تتحرك بسرعة معینة؟
– لقد وضع ماكسویل معادلة ریاضیة لحل ھذه المسألة في عام 1860. ھذه المعادلة تأخذ بعین الإعتبار افتراضات نظریة الحركة الجزیئیة وھذه المعادلة تعتمد على التحلیل الإحصائي لسلوك الجزیئات.
– ومن فروض النظریة الحركیة الجزیئیة:
أن متوسط طاقة حركة الجزیئات تتناسب مع درجة حرارتھا المطلقة. ویجب أن ننظر بشكل فاحص الى توزیع الطاقة الجزیئیة الذي یتضمنه التعبیر متوسط الطاقة الحركیةAverage Kinetic Energy في حالة المادة الثلاثة، تكون الجزیئات في حالة حركة مستمرة (وھذه أوضح ما تكون في الحالة الغازیة)، وبما أن ھذه الجزیئات تصطدم مع بعضھا البعض، فإن بعضھا یفقد سرعته أو جزءاً كبیراً منھا والبعض الآخر تزداد سرعته ومعظم ھذه الجزیئات تكون سرعتھا متوسطة.
– والحقیقة أن جزیئات الغاز لا تتحرك جمیعھا بنفس السرعة ذلك أنه من خلال الإصطدامات التي یحدثھا الجزيء مع الجزیئات الأخرى وتبادله للطاقة خلال تلك الإصطدامات فإن اتجاه الجزيء وسرعته وطاقته تتغیر باستمرار. فمثلاً، یمكن لتصادم ما أن یترك جزیئاً معیناً. في بعض الأحیان، بدون حركة تقریباً، إلى أن یعاني، بعد برھة، من اصطدام آخر فیرسل مرة أخرى في سبیله. ومن الممكن لجزيء آخر أن یتلقى عدة اصطدامات “خلفیة” واحدة تلو الأخرى مما یؤدي الى إعطائه سرعة عالیة جداً. بھذه الطریقة، تتغیر سرعات الجزیئات باستمرار عبر تصادمھا مع بعضھا بعضاً. وفي أیة لحظة، تتحرك بعض الجزیئات ببطء، وبعضھا بسرعة عالیة جداً، رغم أن لمعظمھا سرعات تتراوح ما بین ذلك.
ملاحظات هامة عن السرعات الجزیئیة
(1) تحسب سرعة الجزیئات في العادة على ھیئة متوسط مربع السرعة ولا تحسب السرعة مباشرة
لأن سرعة الجزیئات للغاز غیر ثابتة، حیث تتفاوت بین سرعات منخفضة وسرعات مرتفعة حسب الظروف.
(2) تختلف سرعات جزیئات الغاز؟
لأنه أثناء حركة الجزیئات ینتج عنه تصادمات تؤدي الى تغییر سرعة وحركة وطاقة الجزیئات باستمرار.
** من المعادلة الأساسیة للنظریة الحركیة:
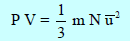
یلاحظ منه أن السرعة الجزیئیة ظھرت على ھیئة متوسط مربع السرعة والسبب ھو اختلاف جزیئات الغاز في السرعة عند نفس الظروف اختلافات تتراوح فیھا السرعة بین سرعات منخفضة جداً الى سرعات مرتفعة جداً، مما یدل على اتساع الإختلاف في السرعات بحیث یمكن تقسیم جزیئات الغاز الى مجموعات كثیرة كل منھا ذات سرعات متقاربة تختلف عن تلك لمجموعة أخرى، وتسمى عملیة التقسیم ھذه بتوزیع سرعة الجزیئات في مجموعات. وھذا التوزیع ینطبق على الطاقة الحركیة للجزیئات لأن:
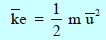
السرعات الجزیئیة للغازات – توزيع ماكسويل وبولتزمان
Maxwell and Boltzman Distribution of Molecular Speeds
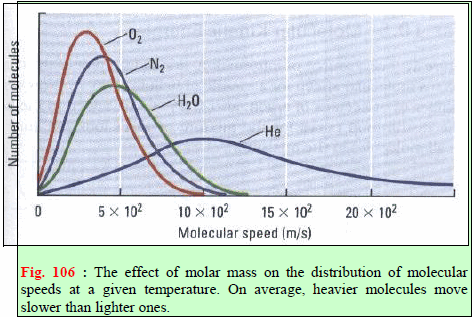
– لقد استطاع العالمان ماكسویل وبولتزمان باستخدام نظریة الاحتمالات للتوصل الى معادلة ریاضیة ھامة تحكم ھذا التوزیع. والتي بینت أن التوزیع الفعلي للسرعات الجزیئیة یعتمد على درجة الحرارة (T) والوزن الجزیئي (Mw).
– وبدون الدخول في تفاصیل اشتقاق قانون التوزیع، سنوضح النتیجة التي توصلا إلیھا من خلال مقارنة توزیع ماكسویل وبولتزمان للسرعات الجزیئیة عند درجات حرارة مختلفة.
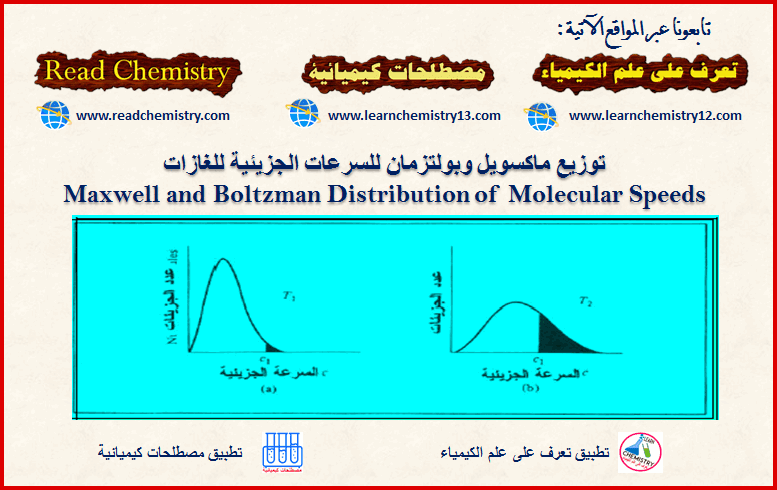
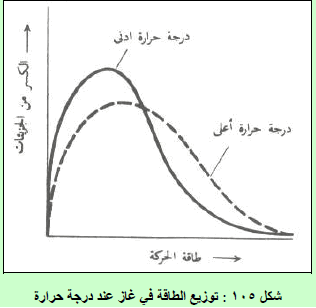
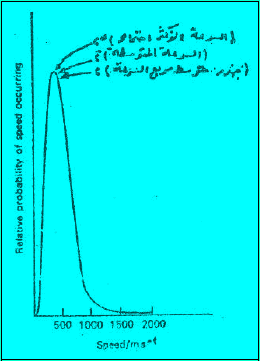
– المنحنيات الآتية تبين العلاقة بین السرعة (أو الطاقة الحركیة) لجزیئات الغاز وعدد الجزیئات عند درجات حرارة مختلفة.
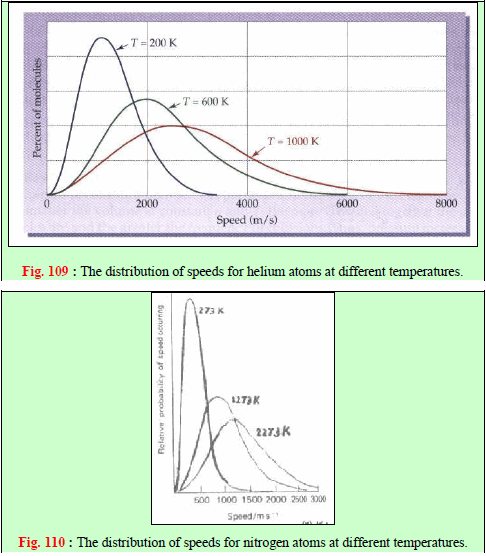
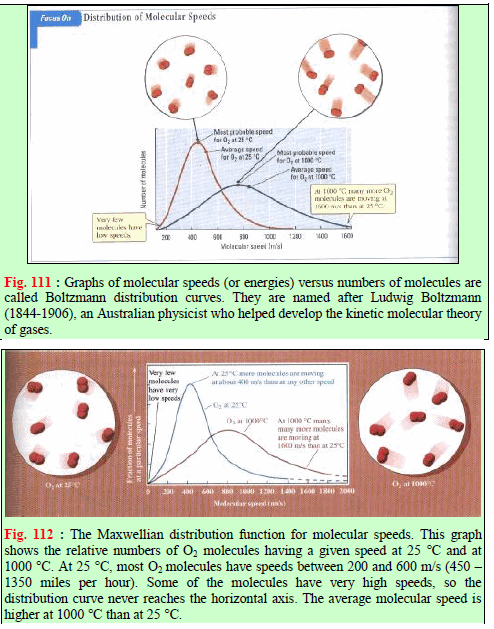
ویظھر من المنحنیات السابقة أن:
(1) نسبة الجزیئات التي لا تتحرك صغیرة جداً (احتمال أن یكون ھنالك جزیئات طاقتھا الحركیة تساوي صفراً ھو احتمال یساوي صفراً في أیة لحظة).
(2) أما بالنسبة للسرعات الأكثر من الصفر فإن النسبة المئویة للجزیئات التي تتحرك بسرعة معینة تزید كلما زادت السرعة وتصل ھذه النسبة عند حد أقصى ثم تتناقص ھذه النسبة مرة أخرى حتى تصل الى الصفر عند السرعات العالیة جداً.
(3) الحد الأقصى للمنحنى (القیمة العلیا على المنحنى) یمثل الطاقة الحركیة للجزء الأكبر من الجزیئات (النسبة المئویة للجزیئات التي تتحرك بالسرعة الأكثر احتمالاً)، أي أن السرعة المقابلة للحد الأقصى للنسبة المئویة ھي السرعة الأكثر احتمالاً (الحركیة الأكثر احتمالاً ،(Most Probable KE) ویرمز لھا بالرمز α
(4) وعند رفع درجة حرارة الغاز یتجه المنحنى ناحیة السرعات الأكبر (یتغیر المنحنى بحیث یزداد متوسط الطاقة الحركیة) ونجد أن نسبة أقل من الجزیئات تتحرك بالسرعات الأصغر ونسبة أكبر من الجزیئات تتحرك بالسرعة الأكبر، وفي المتوسط تتحرك الجزیئات بسرعة أكبر وبمعنى آخر فإن ارتفاع درجة الحرارة قد جعل الجزیئات في المتوسط تتحرك بسرعة أكبر(تتوجه الطاقة ھذه نحو زیادة الطاقة الحركیة وزیادة سرعة الجسیمات)، ویظھر ذلك بوضوح بالنسبة للسرعة الأكثر احتمالاً. ویمكن توضیح معنى السرعة الأكثر احتمالاً على أساس أنعدد الجزیئات الذي یتحرك بھذه السرعة. أكبر من أي عدد یتحرك بأي سرعة أخرى.
(5) أما متوسط الطاقة الحركیة فیحدث عند قیمة أعلى من الطاقة الحركیة الأكثر احتمالاً، وذلك لأن المنحنى غیر متماثل.
العلاقة بین الطاقة الحركیة ودرجة الحرارة
(6) تقودنا العلاقة بین الطاقة الحركیة ودرجة الحرارة الى مفھوم الصفر المطلق، كلما أزیلت الطاقة الحركیة من الجزیئات (بواسطة التبرید) فإن ھذه الجزیئات تصبح حركتھا أبطأ فأبطأ، وعند توقف الجزیئات عن الحركة تصبح طاقتھا الحركیة صفراً، وبما أن الطاقات الحركیة السالبة لا وجود لھا (لا یمكن لجسم أن یتحرك بشكل أبطأ من السكون) ودرجة الحرارة تصبح أقل ما یمكن. وھذا ما یسمى بالصفر المطلق، وھي درجة الحرارة التي تتوقف عندھا الحركة الجزیئیة بأكملھا، ولكن تبقى حركة الإلكترونات داخل الذرات. فبالرغم من كون الجزیئات لا حراك فیھا، إلا أن الإلكترونات تستمر في “دورانھا السریع” حول النوى التي ینتمي إلیھا.
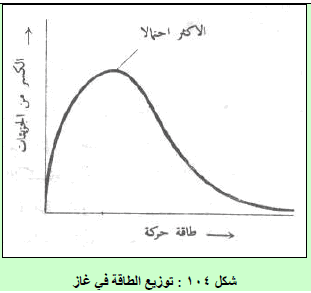
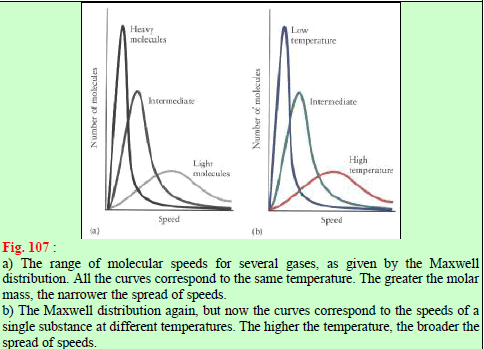
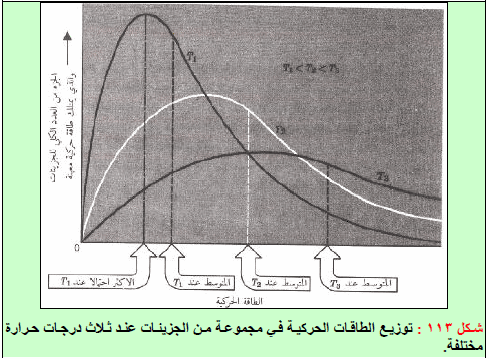
(7) من الشكل (١١٣) یمكن سجیل الملاحظات التالیة:
(أ) الاحتمالیة لوجود جزیئات ذات سرعات منخفضة جداً أو عالیة جداً تكون ضئیلة.
(ب) سرعة أكبر عدد من الجزیئات یكون في قمة المنحنى- تسمى بالسرعة الأكثر احتمالاً – بل تختلف ھذه السرعة لنفس الغاز باختلاف درجة الحرارة فتزداد قیمتھا عند درجات الحرارة العالیة (T1)
(جـ) یزداد عدد الجزیئات ذات السرعات العالیة بازدیاد درجة الحرارة بسبب زیادة الطاقة الحركیة للجزیئات.
مثال توضيحي لتوزيع السرعات الجزیئیة
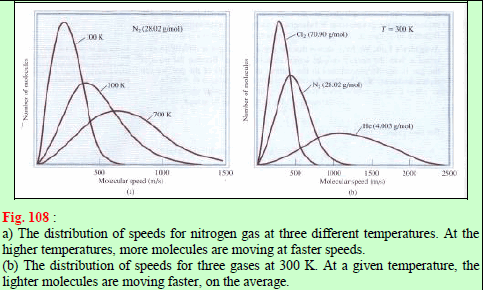
– الشكل التالي يظهر منحنين مثاليين لتوزيع سرعات ماكسويل بالنسبة لغاز النيتروجين عند درجتي حرارة مختلفتين. عند درجة الحرارة المعينة فإن منحنى التوزيع يحدثنا عن عدد الجزيئات التي تتحرك بسرعة معينة.
– توزیع سرعات ماكسویل لغاز النیتروجین عند a حيث درجة الحرارة T1 وعند b حيث درجة الحرارة أعلى من T2
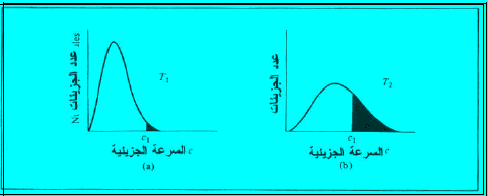
– لاحظ أن المنحنى یصیر مسطحاً بعض الشيء عند درجة الحرارة العالیة. المساحة المظللة تمثل عدد الجزیئات التي تسیر بسرعات أكبر أو تساوي سرعة معینة V1 بحیث أن عدد الجزیئات التي تسیر بسرعات كبيرة يزيد مع زيادة درجة الحرارة.
– إن قمة كل منحنى تعطي أكثر السرعات احتمالیة وھي سرعة أكبر عدد من الجزیئات. ونذكر ھنا أن السرعة الأكثر احتمالیة تكون أكبر عند درجات الحرارة العالیة منھا عند درجات الحرارة المنخفضة.
– وإذا قارنا الجزیئین (a) ، (b) في الشكل السابق فأننا نلاحظ ليس فقط انتقال قمة المنحنى الى الیمین ولكن أیضاً یصیر المنحنى مسطحاً الأمر الذي یعني أن العدد الأكبر من الجزیئات یسیر بسرعات كبیرة.
العلاقة بين السرعة الأكثر احتمالا (u*)– السرعة المتوسطة u᷆ – والجذر التربيعي لمربع متوسط السرعة.
– السرعة الأكثر احتمالاً (u*) (The Most Probable Speed) هى تلك السرعة التي یملكھا الكسر الأعظم من الجزیئات، وبالتالي ھي السرعة التي ترادف النھایة العظمى (Maximum)
– الشكل التالي يوضح توزیع السرعات ذات القیمة المحددة دون تحدید الإتجاه لجزيئات النيتروجين عند 273
– السرعة المتوسطة Mean Speed( u᷆ ): ھي عبارة عن المتوسط الحسابي البسیط للسرعات الفردیة.
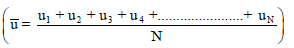
حيث N: عدد أفوجادرو
– الجذر التربیعي لمربع متوسط السرعة ھو:
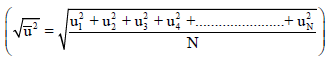
– وإذا كان منحنى التوزیع متماثلاً لكانت السرعة الأكثر احتمالاً(u*) مساوية للسرعة المتوسطة ( u᷆ ) ولكن نظراً لأن المنحنى یكون امتداده للخارج أكبر عند سرعات عالیة، فإن السرعة المتوسطة تكون أكبر من السرعة الأكثر احتمالاً (u > u* )
– مهما كان شكل المنحنى فإن الصحیح دائماً، ھو أن قیمة الجذر التربیعي لمتوسط مربع السرعة سوف تكون أكبر من السرعة المتوسطة ( u᷆ )
– يمكن رياضياً توضیح أنه بالنسبة لعدد كبیر من الجزیئات تكون النسب بین ھذه السرعات كما یلي:
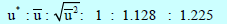
وبالتالي فإن:
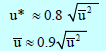
تأثير التغير في درجة الحرارة على منحنى توزيع السرعات الجزیئیة
– ومن المتوقع أن یؤثر التغیر في درجة الحرارة على منحنى توزیع السرعات الجزیئیة. والشكل (١١٠) یوضح منحنیات التوزیع لغاز النیتروجین عند درجات حرارة (273, 1273, 2273 K)
– ومن المھم الإشارة الى أن الزیادة في سرعات الجزیئات عند رفع درجات الحرارة، لا تحدث بالتناسب، وإذا كان ذلك یحدث بالتناسب، لكنا قد رأینا أن المنحنیات – بتتابع درجات الحرارة – سوف تزاح ببساطة نحو الیمین على طول المحور.
– ولكن الذي یحدث ھو التوزیع الفعلي، أو ھي السرعات الجزیئیة التي تتغیر بتغیر درجات الحرارة، بحیث أنه عند درجات الحرارة الأعلى تكون السرعة أكبر. ویعتبر ذلك سمة ھامة لسلوك الجزیئات في الغازات.
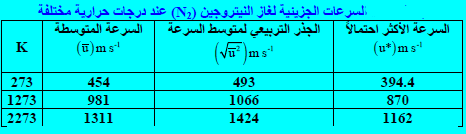
– الجدول التالي يوضح ( السرعة الأكثر أحتمالاً ، الجذر التربیعي لمتوسط السرعة ، السرعة المتوسطة) لغاز النيتروجين عند درجات حرارة ثلاث ترداف المنحنى السابق.
المراجع
– أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية






