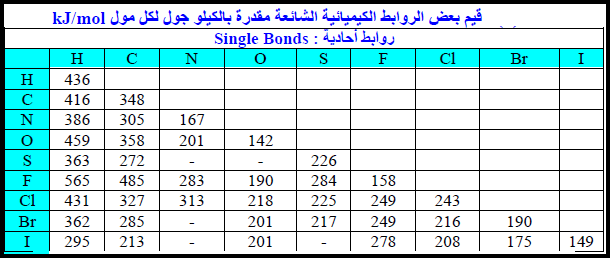
طاقة الرابطة Bond Energy + مسائل محلولة
محتويات الموضوع
تعريف طاقة الرابطة Bond Energy
– تعرف طاقة الرابطة Bond Energy بأنها الطاقة اللازمة لتكسیر رابطة بین ذرتین في جزيء في حالته الغازیة الى ذرات في الحالة الغازیة (جذور متعادلة).
– ویرمز لھا بالرمز BE أو ھي الطاقة الناتجة عن تكوین رابطة بین ذرتین.
– تستخدم طاقة تفكك الرابطة كمقیاس كمي لاستقراریة الجزيء.
– إن تكوین الرابطة عملیة طاردة للحرارة، أما تفكك الرابطة فعملیة ماصة للحرارة.
– كلما كانت الطاقة المنطلقة نتيجة لتكون الرابطـة كبیرة، والطاقة اللازمة لتكسیر الرابطـة أیضاً كبیرة فإن ھذا یدل على أن تكوین الرابطـة یؤدي الى استقرار أكثر.
أمثلة توضيحية على طاقة الرابطة Bond Energy
مثال (1): إذا علمت طاقة الرابطة بین ذرتي الھیدروجین، وذرتي الفلور ھي كما يلي:
فأي الجزيئين (H2 , F2) أكثر استقراراً؟
الحل:
بما أن طاقة الرابطة بین ذرتي الھیدروجین أكبر من طاقة الرابطة بین ذرتي الفلور، فإن الجزئ (H-H) أكثر استقراراً من الجزئ (F-F).
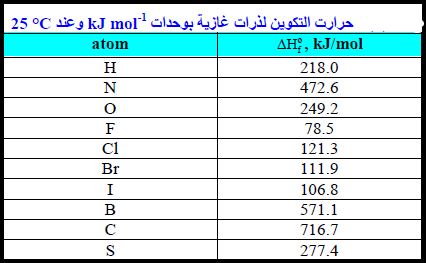
مثال (2): قارن بين ΔHo لتكوين (F-F , H-F , H-Cl , Cl-Cl) إذا علمت أن:
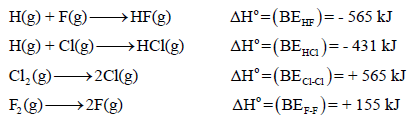
الحل:
من قيم ΔHo فإن طاقة الرابطة نجد أن:
H-F > H-Cl > Cl-Cl > F-F
طاقة الرابطة لجزيئات تحتوي على نوع واحد من الروابط
مثال توضيحي (1)
– إن الطاقة اللازمة لتفكیك جزيء المیثان CH4 إلى أربع ذرات هيدروجين وذرة كربون تساوي 1665 kJ
– لقد وجد أن الطاقة اللازمة لتفكیك كل رابطة (C-H) من على حدة تختلف عن بعضھا البعض كما یتبین مما یلي:
– وكان المفترض أن الطاقة اللازمة لتفكیك كل رابطة تساوى 1664/4 = 416 kJ.mol-1 بسبب أن جمیع الروابط (C-H) متماثلة في الطول والقوة في جزيء المیثان. ولكن الملاحظ أن قیم ΔH4o , ΔH1o , ΔH2o , ΔH3o جمیعھا مختلفة ولا یوجد واحد منھا یساوي فما السبب؟
– السبب يرجع إلى حدوث إعادة تنظيم (rearrangement) للكثافة الإلكترونية عندما تنكسر إحدى الروابط، لذلك فإنه على الرغم من أن الروابط المتبقیة متكافئة إلا أنھا تختلف قليلاً عن الروابط في جزئ الميثان CH4 ، وبالمثل فإن الروابط في (CH2) و (CH) تختلف عن الروابط في (CH3) ، (CH4)
مثال توضيحي (2)
– تصور المعادلة التالیة تفكك 1 مول من النشادر لإعطاء 3 مول من ذرات الھیدروجین ومول واحد من ذرات النیتروجین كما يلي:
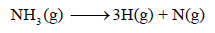
– وبذلك یمكن حساب الطاقة اللازمة لتفككه من المعادلة كما يلي:
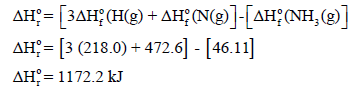
– وتمثل القیمة 1172.2 kJ كمیة الطاقة اللازمة لإحداث تفكك الروابط الثلاث (3N-H) في مول من النشادر كما یمثل ثلث ھذه الكمیة: 1172.7 / 3 = 390.9 kJ وهو متوسط طاقة الربط لمول من روابط (N-H) في جزئ النشادر.
متوسط طاقة الربط في الجزیئات عديدة الذرات
– متوسط طاقة الربط في الجزیئات عديدة الذرات ((ΔHodis.avg تعرف بأنھا متوسط الطاقة اللازمة لتفكك مول من الجزیئات الى ذرات مقسمة على عدد الروابط في الجزيء.
– ومن المفيد التفرقة بين متوسط طاقـة الربط ((ΔHodis.avg وطاقـة تفكك الرابطـة المفردة ((ΔHodis ففي جزئ النشادر يحدث التفكك على خطوات لكل منها طاقة ذاتية لتفكك الرابطـة كما تبينه المعادلات الآتية كما يلي:
– ويبلغ متوسط القيم الثلاثة 391kJ ، وهو متوسط طاقة الرابطة في جزئ النشادر.
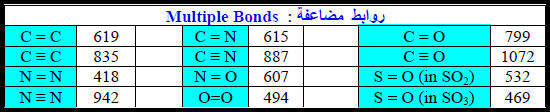
طاقة الرابطة لجزيئات تحتوي على أكثر من نوع من الروابط
– یمكن تقدیر حرارة التفاعل أو التغیر في الإنثالبي ΔH لتفاعل معین باستخدام قیم الرابطة إذا كانت المواد المتفاعلة والناتجة في الحالة الغازیة فقط.
– حیث أن التغیر في الإنثالبي ΔH یساوي الطاقة اللازمة لتكسیر جمیع الروابط في جزیئات المواد المتفاعلة مطروحاً منه الطاقة اللازمة لتكسیر جمیع الروابط في جزیئات المواد الناتجة أي أن:
حيث P: تمثل المواد الناتجة ، R: تمثل المواد المتفاعلة.
أهمية طاقة الرابطة فى تحديد التفاعلات الماصة للحرارة والطاردة للحرارة.
– إذا كانت الروابط في جزیئات المواد الناتجة أقوى منھا في جزیئات المواد المتفاعلة فإن المواد الناتجة تكون أكثر استقراراً، لذلك فإن طاقتھا تكون أعلى من طاقة المواد المتفاعلة ویكون التفاعل في ھذه الحالة تفاعل طارد للحرارة.
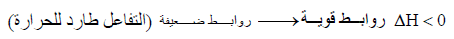
– والعكس صحیح أیضاً إذ نجد أن الحرارة تمتص أحیاناً لیحصل التفاعل وفي ھذه الحالة فإن المواد الناتجة تحتوي على طاقة أقل من طاقة المواد المتفاعلة أي أن :
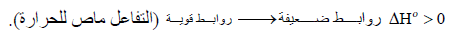
– وتكون المواد الناتجة في ھذه الحالة أقل استقراراً (طاقة المواد الناتجة أقل من طاقة المواد المتفاعلة).
مسائل محلولة على طاقة الرابطة
مثال (1): احسب حرارة التفاعل التالي بطریقة طاقـة الرابطة:
علماً بأن طاقـة الرابطة:
الحل:
مثال (2): إذا كان لدیك التفاعل التالي:
فاحسب التغیر في الإنثالبي لھذا التفاعل إذا علمت أن قیم طاقـة الرابطة:
الحل:
مثال (3): احسب طاقة التفاعل التالي:
فإذا علمت أن متوسط طاقات الروابط بوحدة كیلو جول / مول ھي كما یلي:
الحل:
مثال (4): احسب الطاقة الناتجة عن التفاعل الآتى كما يلي:
فإذا علمت أن متوسط طاقات الروابط بوحدة كیلو جول / مول ھي كما یلي:
ثم بین ھل التفاعل ماص أم طارد للحرارة مع ذكر السبب؟
الحل:
بما أن قیمة ΔHo بالسالب لذلك فالتفاعل طارد للحرارة.
مثال (5): عند إشعال المیثان في جو من الكلور كما بالتفاعل التالي:
فإذا علمت أن متوسط طاقات الروابط بوحدة كیلو جول / مول ھي كما یلي:
فاحسب الطاقة اللازمة لتفاعل (0.5 mol CH4) مع كمية كافية من غاز الكلور.
الحل:
وبما أن قیمة ΔHo بالموجب لذلك فالتفاعل ماص للحرارة. ولحساب الطاقة اللازمة لتفاعل (0.5 mol) من الميثان مع كمية كافية من غاز الكلور.
مثال (6): احسب طاقة الرابطة C = C كما بالتفاعل التالي:
علماً بأن متوسط طاقات الروابط بوحدة كیلو جول / مول ھي كما یلي:
الحل:
المراجع: أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية


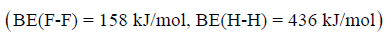
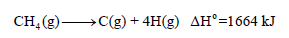


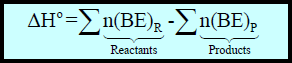
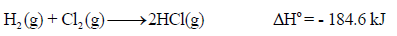
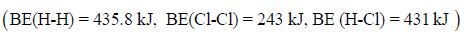
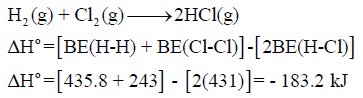
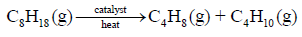
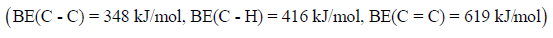
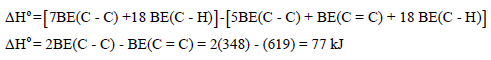
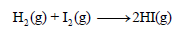
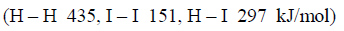
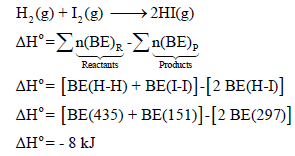
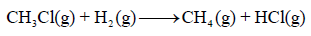
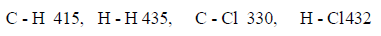
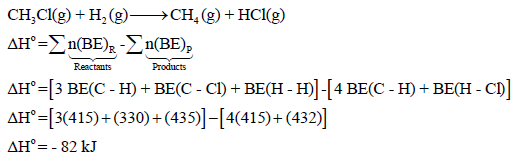
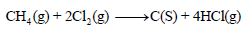
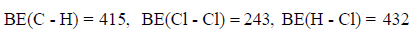
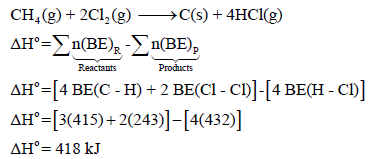
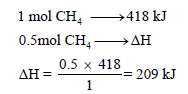
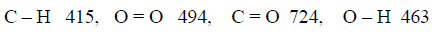
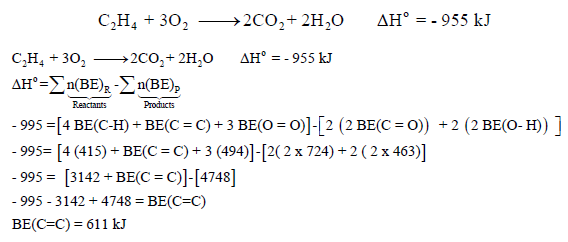




أهلاً وسهلاً بك دائماً فى موقعنا
نعتذر منك … هذا الموقع خاص بالكيمياء فقط
ميرسي
اهلاً وسهلاً بك عزيزى لكم كل الحب و التقدير
شكرا لكم