المعايرات اليودية – تجربة تقدير النحاس في أحد أملاحه الذائبة بواسطة اليود
الأساس النظري لتجربة تقدير النحاس بواسطة اليود (المعايرات اليودية)
تنقسم عمليات الأكسدة بواسطة اليود ( المعايرات اليودية) إلى قسمين كما يلي:
(أ) الطريقة المباشرة Iodimetry
تشتمل على عمليات المعايرة المستخدم فيها محلول معلوم القوة من اليود.
2Na2S2O3 + I2 → Na2S4O6 + 2NaI
(ب) الطريقة غير المباشرة Iodometry
تشتمل على عمليات المعايرة التي ينفرد فيها اليود نتيجة حدوث تفاعل كيميائي.
2CuSO4 + 4KI → Cu2I2 + I2 + 2K2SO4
ويعاير اليود المنفرد بواسطة محلول قياسي من ثيوكبريتات الصوديوم .
ملاحظات على المعايرات اليودية
– لا يمكن تحضير محلول قياسي أولي من اليود لأنه سهل التطاير ولذلك فإن محلوله في الماء يتغير تركيزه باستمرار.
– في عمليات التأكسد المباشر يذاب اليود في يوديد البوتاسيوم وكلما زاد تركيز يوديد البوتاسيوم كلما زادت قابلية ذوبان اليود وذلك لتكون ثالث يوديد البوتاسيوم.
– يتفاعل ثالث يوديد البوتاسيوم بنفس الطريقة تماما مثل محلول اليود فالضغط البخاري لمحلول ثالث يوديد البوتاسيوم أقل من الضغط البخاري لمحلول اليود في الماء النقي ولذلك يقل تطاير اليود في محلول ثالث يوديد البوتاسيوم ويعاير اليود هذا مع ثيوكبريتات الصوديوم.
– يمكن أن يعمل اليود كدليل ذاتي لأنه عند الاختزال يختفي اللون البني لليود وتتكون أيونات اليوديد عديمة اللون.
– بالرغم من ذلك فإن تحول اللون من البني إلى عديم اللون غير كاف لاكتشاف نقطة التكافؤ لذلك يستخدم محلول النشا كدليل حيث يعطي اللون الأزرق مع اليود.
تجربة تقدير النحاس بواسطة اليود (المعايرات اليودية)
تقدير النحاس في أحد أملاحه الذائبة بطريقة المعایرات الیودیة (باستخدام محلول 10 %من یودید البوتاسيوم).
الهدف من تجربة تقدير النحاس بواسطة اليود (المعايرات اليودية)
– تعیين مولاریة وتركیز أیون النحاس في محلول أحدى أملاحه الذائبة مثل (كبریتات النحاس) وفق المعادلة كما يلي:
– التجربة هي أحدى تطبيقات معايرات الأكسدة والاختزال باستخدام اليود ( الطريقة الغير مباشرة Iodometry method)
– یتفاعل كاتیون النحاس الثنائي (II) مع أنیون الیودید طبقاً للمعادلة السابقة حیث یتكون راسب أبیض من یودید النحاس ، وهذا الراسب ليس له أي تأثیر على معایرة الیود المتحرر من التفاعل السابق والذي تتم معایرته بواسطة محلول قیاسي من ثیوكبریتات الصودیوم ویتم التفاعل بین الیود المتحرر وثیوكبریتات الصودیوم 0.05 M (Na2S2O3.5H2O)
– يتم التفاعل بين اليود المتحرر وثيوكبريتات الصوديوم وفقاً للمعادلة الآتية:
– یستخدم دلیل النشا كدلیل في هذه المعایرة حیث یكون الیود متراكب ازرق مع دلیل النشا ویزول هذا اللون عند نقطة نهایة التفاعل (نقطة التكافؤ).
– أما أملاح النحاسیك تتفاعل مع یودید البوتاسیوم حیث یترسب یودید النحاسیك أولاً ویتحلل مباشرة یودید النحاسوز CuI وهو عبارة عن راسب ابيض ویود I2 حیث یذوب الیود في زیادة محلول یودید البوتاسیوم ملوناً المحلول باللون البني المحمر ویعایر الیود المتحرر بواسطة محلول قیاسي من ثیوكبریتات الصودیوم 0.05 M (Na2S2O3.5H2O)
– هذه المعایرة هي معایرة یودیدیة غیر مباشرة Iodometry
المواد الكيميائية المستخدمة في التجربة
المواد الكيميائية المستخدمة في التجربة كما يلي:
(1) محلول كبریتات نحاس مجهولة التركیز.
(2) محلول 10%من يوديد البوتاسيوم ، ويحضر بإذابة 10 جم من ملح يوديد البوتاسيوم في 100 مل مقطر.
(3) ثیوسیانات البوتاسیوم أو تیوسیانات الأمونیوم (5%)
(4) حمض الكبریتیك أو حمض الهیدروكلوریك (5 N)
(5) یودات البوتاسیوم KIO3 قياسي (0.05M) تستخدم لضبط مولارية محلول ثيوكبريتات الصوديوم القياسي.
(6) محلول ثیوكبریتات الصودیوم القیاسي (0.05M) ويتم ضبط مولاريتها عن طريق معايرتها بواسطة يودات البوتاسيوم المضاف إليها محلول البوتاسيوم 15)مل) ليحرر (3I2) ثلاثة جزیئات من الیود الذي يعایر بواسطة ثیوكبریتات الصودیوم ویتم حساب مولاریة الثیوكبریتات لضبط مولاریتها.
(7) الدلیل (محلول النشأ) الذي یحضر بمزج ( 2جم) من النشا القابل للذوبان و ( 10 جم) من یودید الزئبقیك مع قلیل من الماء المقطر ثم أضف العالق ببطيء إلى لتر من الماء المقطر المغلي ویتم استعماله كل ( 5 مل من محلول النشا لكل 100 مل من محلول العینة).
الأدوات المستخدمة في التجربة
الأدوات المستخدمة في التجربة كما يلي:
- سخان كهربائي
- قطارة
- سحاحة وحامل السحاحة
- ماصة قیاسیة
- دورق مخروطي 400 مل
- كأس زجاجية سعة 400 مل
- ساق زجاجیة
خطوات تجربة تقدير النحاس بواسطة اليود (المعايرات اليودية)
يجب عليكم أجراء خطوات التجربة كما يلي:
(1) املأ السحاحة بمحلول ثیوكبریتات الصودیوم القیاسي حتى صفر التدریج مع ملاحظة عدم وجود فقاعات هواء والتأكد من امتلاء الجزء ما تحت الصنبور.
(2) أنقل بالماصة 50 مل من محلول كبریتات النحاس المجهول التركیز إلى دورق مخروطي سعة 250 مل.
(3) أضف إلى الدورق 2 مل من حمض الكبریتیك والهیدروكلوریك (5 N).
(4) اضف إلى الدروق المخروطي (15 مل من محلول یودید البوتاسیوم 10 % ولاحظ ماذا یحدث للمحلول).
(5) إبدء عملیة المعایرة للیود المتحرر في الدورق المخروطي بواسطة محلول الثیوكبریتات القیاسي بتنقیط المحلول من السحاحة قطرة قطرة مع الرج واستمر في عملیة المعایرة حتى یصبح لون المحلول أصفر شاحب.
(6) اضف إلى الدورق 5 مل من محلول النشا + 10 مل من محلول ثيوسیانات البوتاسیوم أو ثیوسیانات الامونیوم ورج الدورق جیداً لكي یتمزج الخلیط واستمر في عملیة المعایرة بالاستمرار في تنقیط محلول الثایوكبریتات من السحاحة قطرة ، قطرة مع الرج حتى یزول اللون الأزرق ویصبح لون المحلول شفاف ولون الراسب أبیض.
(7) كرر التجربة مرتين ودون النتائج في جدول وخذ متوسط الحجم.
(8) احسب مولارية وعيارية وقوة النحاس في كبريتات النحاس
الحسابات
(1) حساب المولارية Morality
من معادلات التفاعل السابقة نجد أن:
(Na2S2O3) 2(M2 × V2) = 2(M1 × V1) (Cu+2)
بما أن عدد المولات متساویة بالنسبة لمواد الأكسدة والاختزال فتصبح الحسابات كما يلي:
(Na2S2O3) M2 × V2 = M1 × V1 (Cu+2)
ومنها یمكن حساب تركیز النحاس بالوحدات المختلفة حسب المطلوب.
(2) حساب العيارية Normality
تحسب من كما بالعلاقة التالية:
(Na2S2O3) N2 × V2 = N1 × V1 (Cu+2)
(3) حساب قوة المحلول strength
قوة محلول النحاس (جم/لتر) = العيارية × الوزن المكافئ
S = N × eq. weight
تعليمات السلامة داخل المختبر الكيميائي
يجب عليك قبل بدء التجربة مراعاة الآتي:
(1) يجب مراعاة نظافة المختبر والأدوات المستخدمة به.
(2) يجب عدم إلقاء المواد الكيماوية بالأحواض إلا بعد تخفيفها ، كما لا يجوز نهائيا إلقاء قطع أو قشور الصوديوم في الأحواض.
(3) يجب أن تكون الأرضيات وكذلك أسطح الطاولات من مواد مقاومة للحريق والمواد الكيماوية وسهلة التنظيف.
(4) يجب غسل الأواني التي بها بقايا مواد سريعة الاشتعال بعد انتهاء العمل بها.
(5) يجب عدم تخزين الكيماويات أو عينات المواد المراد حفظها داخل المختبر إلا بأقل قدر ممكن ولحاجة العمل فقط.
(6) يجب عدم حفظ السوائل السريعة التبخر إلا في الثلاجات، كما يجب الانتباه عند تغطية زجاجات الكيماويات.
(7) يجب وضع إناء مملوء بالرمل تحت القناني التي لا يوجد سبيل آخر لحمايتها ، واعلم أن استخدام الرمال والتراب لامتصاص الأحماض المنسكبة على الأرض من الوسائل الآمنة من وجهة نظر السلامة.
(8)عند تسخين مواد سريعة الاشتعال يجب استخدام حمام مائي .
تعليمات أخري
(9) لا تحاول أن تدخل بقوة أنبوبة في سدادة فلين أو مطاط ، بلل الزجاج بالماء أو الزيت أولاً لأن ذلك يسهل ألي حد كبير هذه العملية.
(10) يجب تداول المواد الخطرة حسب الأسس العلمية ، وكمثال عند تخفيف حمض الكبريتيك فأن الحمض يضاف للماء ولا يضاف الماء إليه .
(11) يجب عدم استخدام المواد الخطرة كالفوسفور إلا تحت الإشراف الفعلي لمسئول المختبر. كما يجب مراعاة حفظ الفوسفور الأبيض والأصفر تحت سطح الماء لمنع اشتعالها تلقائيا حيث إنها تشتعل بمجرد تعرضها للهواء.
(12) يجب أن يكون بكل مختبر أكثر من مخرج وكما يفضل أن تكون الأبواب من النوع المفصلي التي تفتح للداخل والخارج.
(13) يجب أن يتأكد محضر المختبر من فصل الكهرباء وإغلاق الغاز والماء عند انتهاء العمل بالمختبر يومياً ما لم يكن هناك أجهزة تلزمها الكهرباء باستمرار مثل الثلاجات أو أجهزة تكييف الهواء لظروف معينة
(14) يجب على محضر المختبر إجراء التفتيش الدوري على توصيلات الغاز والمياه والمجاري والكهرباء للتأكد من سلامتها والإبلاغ عن أي خلل بها فور اكتشافه.
(15) يجب على محضر المختبر التأكد من توفير التهوية المناسبة والإضاءة المناسبة بالمختبر.
(16) يجب التأكد من أن غرفة الغازات (غرفة التجارب) محكمة الغلق لمنع تسرب الغازات الضارة منها أثناء إجراء التجارب الخطرة وأن تكون مزودة بمروحة سحب مناسبة.
المراجع:
– كتاب تجارب في الكيمياء التحليلية (التحليل الكمي الحجمي والوزني) / مسعود فرج أبو سته / كلية العلوم – جامعة سبها
– الكيمياء التحليلية الكمية (التحليل الحجمي والوزني) الجزء العملي للفصل الدراسي الثاني للفرقة الثانية كيمياء/ ريم محمد الغانمي/1429 – 1430 هـ/ جامعة الملك عبد العزيز/ السعودية


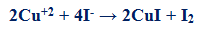
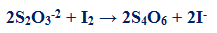
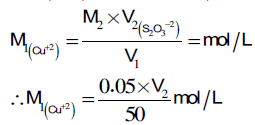





مفيد جداً