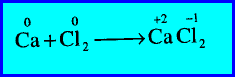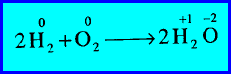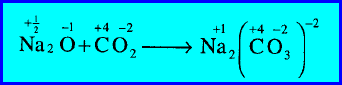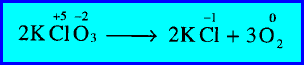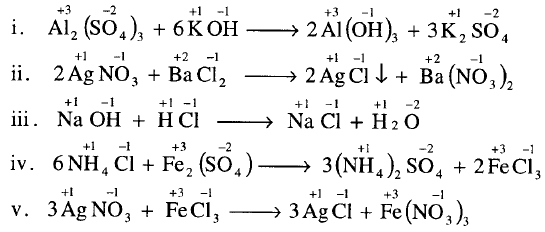أنواع تفاعلات الأكسدة والأختزال Redox Reactions
محتويات الموضوع
أنواع تفاعلات الأكسدة والأختزال
يمكن تقسيم تفاعلات الأكسدة والأختزال كما يلي:
(1) تفاعلات الاتحاد المباشر Combination reactions
(2) تفاعلات الانحلال Decomposition reactions
(3) تفاعلات الاحلال البسيط Simple Displacement reactions
(1) تفاعلات الاتحاد المباشر Combination reactions
– تعرف تفاعلات الاتحاد المباشر بأنها التفاعلات التي يتحد بها عنصران أو مركبان اتحاداً مباشراً ليعطيا مركباً آخر ويمكن تقسيمها كما يلي:
(أ) اتحاد عنصرين
A + B → AB
مثال (1): اتحاد الأكسجين مع بعض العناصر
– يتحد الكربون مع الأكسجين لتكوين غاز ثاني أكسيد الكربون أو غاز أول أكسيد الكربون
– واتحاد الأكسجين مع الكبريت لتكوين ثاني أكسيد الكبريت.
– واتحاد الماغنسيوم مع الأكسجين لتكوين أكسيد الماغنسيوم كما بالمعادللات الآتية:
– في التفاعلات (iii , ii , i ) ازداد رقم التأكسد لكل من ذرتي الكربون (C) وذرة الكبريت (S) من صفر إلى (+2 , +4) ، (+4) على التوالي (أكسدة) ونقص رقم التأكسد لذرة الأكسجين (O) في كل منهما من صفر إلى (-2) (اختزال).
– بينما في التفاعل (iv) زاد رقم التأكسد لذرة الماغنسيوم (Mg) من صفر إلى (+2) (أكسدة) ونقص أيضاً رقم التأكسد لذرة الأكسجين (O) من صفر إلى (-2) (اختزال)
مثال (2): اتحاد الكالسيوم مع الكلور لتكوين كلوريد الكالسيوم
– زاد رقم التأكسد لذرة الكالسيوم (Ca) من صفر إلى (+2) (أكسدة).
– كما نقص رقم التأكسد لذرة الكلور (Cl) من صفر إلى (-1) (اختزال).
مثال (3): اتحاد الحديد مع الكبريت لتكوين كبريتيد الحديدوز
– زاد رقم التأكسد لذرة الحديد (Fe) من صفر إلى (+2) (أكسدة).
– كما نقص رقم التأكسد لذرة الكبريت (S) من صفر إلى -2)) (اختزال).
مثال (4): اتحاد الهيدروجين مع الكلور لتكوين كلوريد الهيدروجين
– زاد رقم التأكسد لذرة الهيدروجين (H) من صفر إلى (+1) (أكسدة).
– كما نقص رقم التأكسد لذرة الكلور (Cl) من صفر إلى (-1) (اختزال).
مثال (5): اتحاد الهيدروجين مع الأكسجين لتكوين الماء
– زاد رقم التأكسد لذرة الهيدروجين (H) من صفر إلى (+1) (أكسدة).
– كما نقص رقم التأكسد لذرة الأكسجين (O) من صفر إلى (-2) (اختزال).
(ب) اتحاد مركبين
– تفاعل مركبين مع بعضهما لتكوين مركب جديد كما بالمعادلة العامة الآتية:
AB + CD → ABCD
مثال (1): اتحاد أكسيد الصوديوم مع ثاني أكسيد الكربون لتكوين كربونات الصوديوم
– زاد رقم التأكسد لذرة الصوديوم (Na) من (+1/2) إلى (+1) (أكسدة).
– كما نقص رقم التأكسد لذرة الأكسجين (O) من (-1) إلى (-2) (اختزال).
(2) تفاعلات الانحلال Decomposition reactions
– هو عكس تفاعلات الاتحاد حيث يتحلل المركب إلى عناصره أو مركبات أبسط ويكون على الصورة كما يلي:
A + B → AB
مثال (1): تحلل أكسيد الزئبقيك إلى زئبق وأكسجين
– زاد رقم التأكسد لذرة الأكسجين (O) من (-2) إلى صفر (أكسدة).
– كما نقص رقم التأكسد لذرة الزئبق (Hg) من (+2) إلى صفر (اختزال).
مثال (2): تحلل كلورات البوتاسيوم إلى كلوريد بوتاسيوم وأكسجين
– زاد رقم التأكسد لذرة الأكسجين (O) من (-2) إلى صفر (أكسدة).
– كما نقص رقم التأكسد لذرة الكلور (Cl) من (+5) إلى (-1) (اختزال).
(3) تفاعلات الاحلال البسيط Simple Displacement reactions
حيث يستبدل أحد عناصر المركب بعنصر آخر لإنتاج مركب جديد وعنصر ويكون كما بالمعادلة الآتية:
C + AB → CB + A
مثال (1): تفاعل الزنك مع كبريتات النحاسوز لإنتاج كبريتات الزنك والنحاس
– زاد رقم التأكسد لذرة الزنك (Zn) من صفر إلى (+2) (أكسدة).
– كما نقص رقم التأكسد لذرة النحاس (Cu) من (+2) إلى صفر (اختزال).
مثال (2): تفاعل الزنك مع حمض الكبريتيك لإنتاج كبريتات الزنك وغاز الهيدروجين
– زاد رقم التأكسد لذرة الزنك (Zn) من صفر إلى (+2) (أكسدة)
– كما نقص رقم التأكسد لذرة الهيدروجين (H) من (+1) إلى صفر (اختزال).
مثال (3): تفاعل الحديد مع نترات النحاس لإنتاج نترات الحديدوز والنحاس
– زاد رقم التأكسد لذرة الحديد (Fe) من صفر إلى (+2) (أكسدة)
– كما نقص رقم التأكسد لذرة النحاس (Cu) من (+2) إلى صفر (اختزال).
مثال (4): تفاعل الزنك مع حمض الهيدروكلوريك لإنتاج كلوريد الزنك وغاز الهيدروجين
– زاد رقم التأكسد لذرة الزنك (Zn) من صفر إلى (+2) (أكسدة)
– كما نقص رقم التأكسد لذرة الهيدروجين (H) من (+1) إلى صفر (اختزال).
ملاحظات هامة عن تفاعلات الأكسدة والأختزال
– يتضح من الأمثلة السابقة أنه عند انتقال الإلكترونات من ذرة إلى ذرة أخرى أو مجموعة ذرية في نفس التفاعل أي تتغير أرقام التأكسد فهذا ما يعرف بتفاعلات الأكسدة والاختزال.
– في التفاعلات الآتية لا يوجد انتقال الإلكترونات من ذرة إلى أخرى أو مجموعة ذرية فهي ليست تفاعلات أكسدة واختزال (Non-Redox).
– بينما تعتبر تفاعلات جزيئية يتم وزنها بالتفتيش مثل تفاعلات التعادل وتفاعلات التبادل المزدوج (الترسيب) كما هو موضح في التفاعلات الاتية:
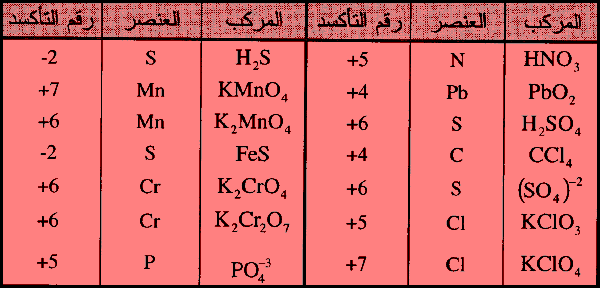
– أمثلة على حساب رقم التأكسد كما يلي:
اهم كواشف في تفاعلات الأكسدة والأختزال
Common Oxidizing and Reducing agents
– الصورة التالية توضح بعض الكواشف المؤكسدة Common Oxidizing agents كما يلي
– الصورة التالية توضح الكواشف المختزلة كما يلي:
موضوعات أخري متعلقة بالأكسدة والأختزال كما يلي:
(1) كيفية تمييز تفاعلات الأكسدة والاختزال Redox reactions عن غيرها من التفاعلات
(2) وزن معادلات الأكسدة والاختزال Redox equations
(3) القدرة على الأكسدةوالأختزال عن طريق قياسات القوة الدافعة الكهربية
المراجع – مبادئ الكيمياء العامة (نظري – مسائل محلولة). محي الدين البكوش – نوري بسيبسو – ياسر حورية – نبيل شيخ قروش، الطبعة الثانية (2003م) / شركة الجا للنشر العلمي – طرابلس.