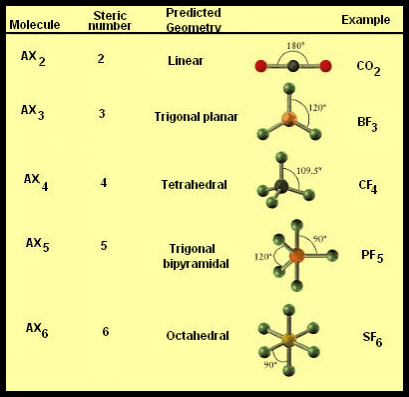
الشكل الهندسي للجزيء والزاوية بين الروابط
– بعد أن تمكنا من معرفة بنية لويس لأي مركب وفقاً للقواعد التي ذكرناها في الموضوع السابق (بنية لويس – تركيب لويس) نستطيع الآن أن نحدد الزاوية بين الروابط وأيضاً نتوقع الشكل الهندسي للجزيء وذلك باستخدام نظرية تنافر زوج الإلكترونات لغلاف التكافؤ Valence Shell Electron Pair Repulsion Theory (VSEPR)
– تتلخص نظرية تنافر زوج الإلكترونات لغلاف التكافؤ في أن أزواج الإلكترونات المحيطة بالذرة المركزية تتنافر نظراً لكونها إلكترونات تحمل شحنات سالبة ومن ثم تحاول أن تبتعد عن بعضها ما أمكن ذلك. والشكل الهندسي الذي يسمح بأكبر بعد بين أزواج هذه الإلكترونات ، هو الذي يحدد الشكل الهندسي للجزيء Molecular geometry
محتويات الموضوع
نظرية تنافر الأزواج الإلكترونية لغلاف التكافؤ (VSEPR)
– نظرية تنافر الأزواج الإلكترونية لغلاف التكافؤ تعرف بالإنجيلزية: Valence Shell Electron Pair Repulsion Theory (VSEPR)
– هي عبارة قاعدة أساسية لفهم تصور زوايا الربط في الجزئيات العضوية.
– ولقد أعطت إمكانية التنبؤ بترتيب الذرات أو المجموعات في الجزيئات وبالتالي وصف الشكل الهندسي للجزيء.
– من أهم قواعد نظرية تنافر الأزواج الإلكترونية لغلاف التكافؤ (VSEPR) كما يلي:
(1) الذرة المركزية Central atom: هي تلك الذرة المرتبطة تساهمياً مع ذرتين أو أكثر.
(2) كل أزواج إلكترونات التكافؤ في الذرة المركزية التي تشترك في الرابطة التساهمية تسمى بإزواج رابطة Bonding والتي لا تشترك في الرابطة تسمى أزواج غير رابطة nonbonding
(3) تتنافر الأزواج الإلكترونية في غلاف التكافؤ أقصى ما يمكن فيما بينها حتى تصل إلى الشكل الهندسي الأكثر استقرار (أقل طاقة وأقل تنافر).
(4) التنافر الأكبر يكون بين الأزواج الإلكترونية غير الرابطة Lone pair لأنها تكون تحت تأثير نواة واحدة فقط فتأخذ حجم زاوي أكبر من حجم الأزواج الإلكترونية الرابطة bond pair
(5) تتخذ الروابط الزوجية فراغا أكبر من الروابط الأحادية.
(6) عند وصف الشكل العام لجزيء ما لابد من حساب كل الأزواج الرابطة وغير الرابطة.
(7) عند وصف ا لشكل الخاص لجزيء ما يتم الرجوع فقط لمواقع الأنوية مع إهمال أزواج الإلكترون غير الرابطة.
(8) تعامل إلكترونات الروابط المتعددة وكأنها وحدة واحدة.
– وبتطبيق هذه النظرية على بعض المركبات نستطيع معرفة الشكل الهندسي للجزيء Molecular geometry ومن ثم الزاوية بين الروابط Bond angles
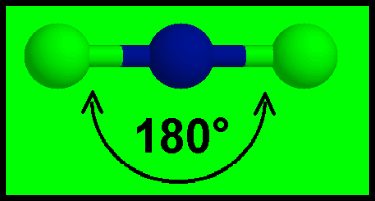
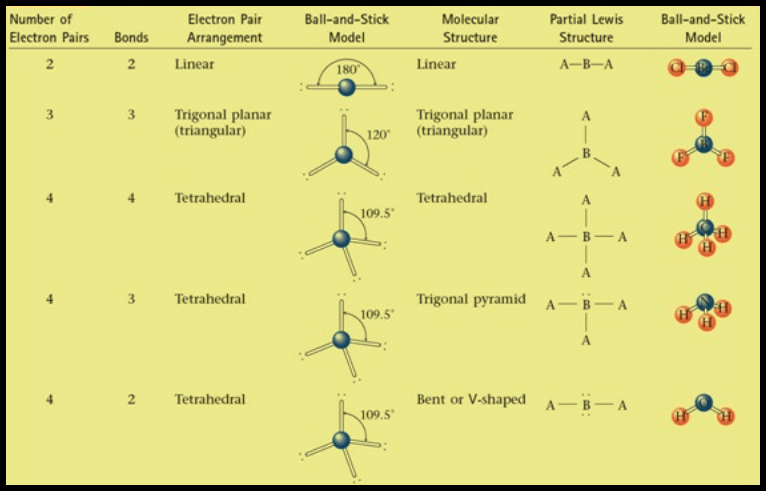
(1) الشكل الهندسي للجزئ AB2
– فى هذا النوع من الجزئيات AB2 نجد أن هناك زوجين من الإلكترونات حول الذرة المركزية.
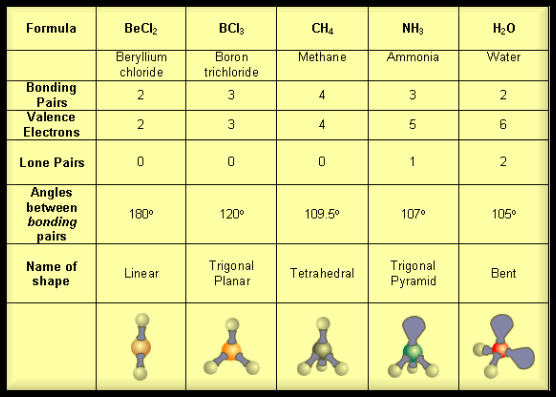
مثال: جزئ كلوريد البريليوم BeCl2
– في مركب جزئ كلوريد البريليوم BeCl2 نجد أن هناك زوجين من الإلكترونات حول الذرة المركزية (البريليوم)
– عدد الإلكترونات الخارجية المكونة لروابط الجزئ = 7 + 7 + 2 = 16 إلكترون.
– تكون الذرة المركزية البريليوم Be محاطة برابطتين تساهميتين والشكل الهندسي الذي يسمح بأكبر بعد بينهما نتيجة التنافر بين إلكتروناتها هو الشكل المستقيم وتكون الزاوية بين الروابط 180o
– ولذلك يكون الشكل الهندسي لجزئ BeCl2 خطاً مستقيماً Linear والزاوية بين الروابط 180o
وهذا يشكل أحد شواذ قاعدة لويس حيث الذرة المركزية محاطة بأربعة إلكترونات فقط بدلاً من ثمانية.
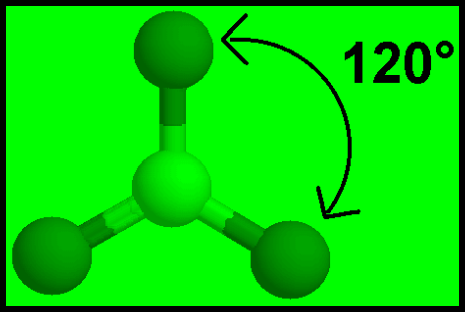
(2) الشكل الهندسي للجزئ AB3
– فى هذا النوع من الجزئيات AB3 نجد أن هناك ثلاثة أزواج من الإلكترونات حول الذرة المركزية.
مثال: ثلاثي كلوريد البورون BCl3
– في جزئ كلوريد البريليوم BCl3 نجد أن هناك ثلاث أزواج من الإلكترونات حول الذرة المركزية (البورون).
– عدد الإلكترونات الخارجية المكونة لروابط الجزيء = (7×3) + 5 = 26 إلكترون.
– لذلك بنية لويس لهذا المركب كما يلي:
– وتكون الذرة المركزية البورون (B) محاطة بثلاثة روابط تساهمية والشكل الهندسي الذي يسمح بأكبر بُعد بين هذه الروابط هو مثلث متساوي الأضلاع (Trigonal planar (triangular
– تكون الذرة المركزية فى وسط المثلث، والذرات الثلاث الأخرى تقع عند رؤوس هذا المثلث وتكون والزاوية بين الروابط 120o
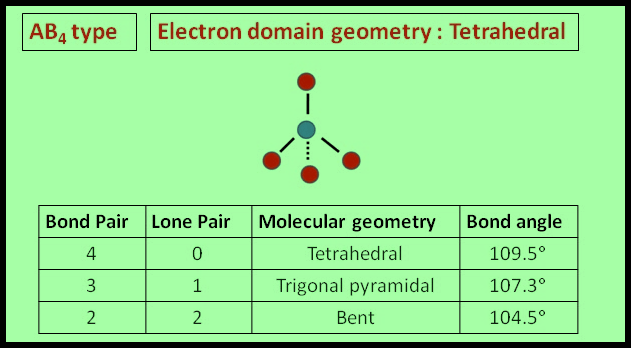
(3) الشكل الهندسي للجزئ AB4
– فى هذا النوع من الجزئيات AB4 نجد أن هناك أربعة أزواج من الإلكترونات حول الذرة المركزية.
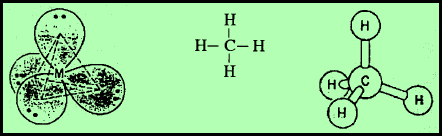
مثال: غاز الميثان CH4
– في جزئ غاز الميثان CH4 نجد أن هناك أربعة أزواج من الإلكترونات حول الذرة المركزية (الكربون).
– عدد الإلكترونات الخارجية المكونة لروابط الجزيء = (1×4) + 4 = 8 إلكترونات
– وتكون الذرة المركزية الكربون C محاطة بأربعة روابط تساهمية أو أربعة أزواج من الإلكترونات.
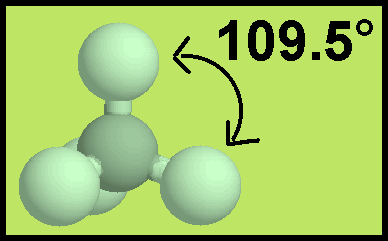
– ونظراً لتنافر إلكترونات هذه الروابط فإن الشكل الهندسي الذي يسمح بأكبر بُعد بين هذه الروابط هو شكل رباعي السطوح Tetrahedral
– تكون الذرة المركزية في مركز الشكل الرباعي والذرات المحيطة بالذرة المركزية تقع عند رؤوس هذا الشكل.
– ينطبق على المركبات الآتية أيضاً كما يلي:
SeCl4 , SiCl4 , CCl4 , PH4+
– والزاوية بين الروابط هي زاوية الشكل الرباعي السطوح وهي 109.5o
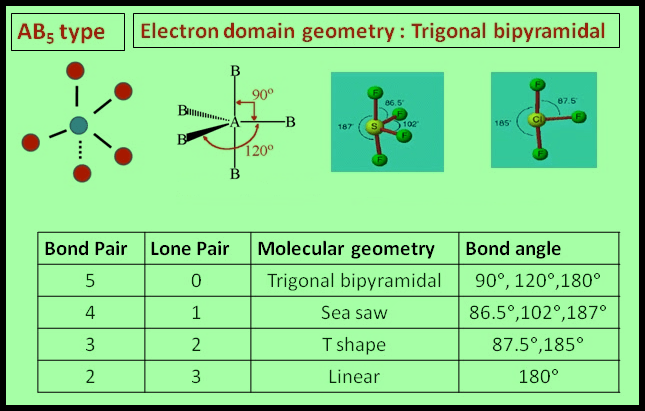
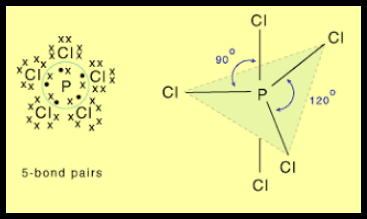
(4) الشكل الهندسي للجزئ AB5
– فى هذا النوع من الجزئيات AB5 نجد أن هناك خمسة أزواج من الإلكترونات حول الذرة المركزية.
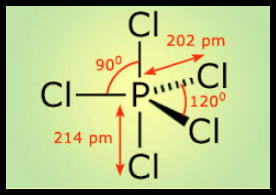
مثال: خامس كلوريد الفوسفور PCl5
– في جزئ خامس كلوريد الفوسفور PCl5 نجد أن هناك خمسة أزواج من الإلكترونات حول الذرة المركزية (الفوسفور).
– عدد الإلكترونات الخارجية المكونة لروابط الجزيء = (5×7) + 5 = 40 إلكترون
– وتكون الذرة المركزية الفوسفور P محاطة بخمسة روابط تساهمية أو خمسة أزواج من الإلكترونات.
– ونظراً لتنافر إلكترونات هذه الروابط فإن الشكل الهندسي الذي يسمح بأكبر بُعد بين هذه الروابط هو ثنائي هرم (مثلثي) Trigonal Bipyramid.
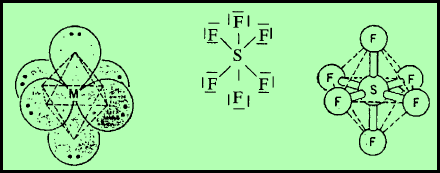
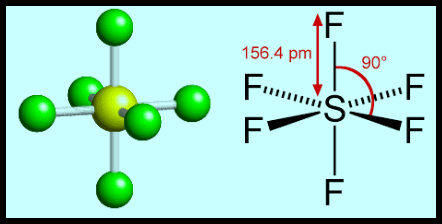
(5) الشكل الهندسي للجزئ AB6
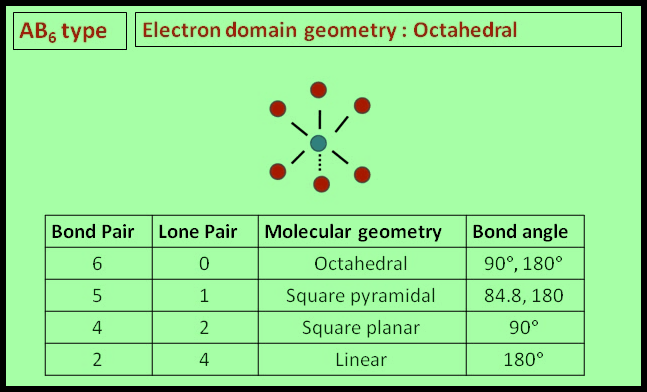
– فى هذا النوع من الجزئيات AB6 نجد أن هناك ستة أزواج من الإلكترونات حول الذرة المركزية.
مثال: سداسي فلور الكبريت SF6
– في جزئ سداسي فلور الكبريت SF6 نجد أن هناك ستة أزواج من الإلكترونات حول الذرة المركزية (الكبريت).
– عدد الإلكترونات الخارجية المكونة لروابط الجزيء = (7×6) + 6 = 48 إلكترون
– وتكون الذرة المركزية الكبريت S محاطة بستة روابط تساهمية أو ستة أزواج من الإلكترونات.
– ونظراً لتنافر إلكترونات هذه الروابط فإن الشكل الهندسي الذي يسمح بأكبر بُعد بين هذه الروابط هو شكل ثماني السطوح أو ثنائي هرم (رباعي السطوح) Octahedron
– عموماً فإن الزاوية بين الروابط تتحدد بعدد الإلكترونات المحيطة بالذرة المركزية سواءاً كانت تشارك في روابط أم لا، بينما يتحدد الشكل الهندسي بعدد الذرات المحيطة بالذرة المركزية.
(6) الشكل الهندسي عندما توجد إلكترونات غير مشاركة في الروابط
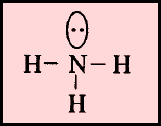
(أ) الحالة التي تكون فيها الذرة المركزية محاطة بأربعة أزواج من الإلكترونات، وزوج واحد منها لا يشارك في الرابطة
مثل: الأمونيا NH3
– إن الشكل الهندسي الذي يسمح بأكبر بعد بين أزواج الإلكترونات الأربعة هو شكل رباعي السطوح.
– وحيث أن أحد هذه الأزواج (lone pair) لا يشارك في رابطة ولابد له أن يشكل حجماً حول الذرة المركزية أكبر من الرابطة فهو لذلك يدفع الروابط إلى الداخل فتقل الزاوية بينهما عن 109.5o وقد وجد أنها تساوي 107o ويسمى الشكل الهندسي هرمي Pyramidal
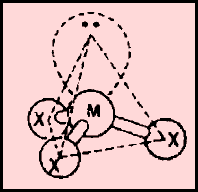
(ب) الحالة التي تكون فيها الذرة المركزية محاطة بأربعة أزواج من الإلكترونات، وزوجين منها لا يشاركان في الروابط
مثل: الماء H2O
– كان من المفترض أن يكون الشكل الهندسي الذي يسمح بأكبر بعد بين أزواج الإلكترونات الأربعة هو شكل رباعي السطوح ولكن يوجد زوجين من الإلكترونات لا يشاركان في الروابط.
– حيث أنهما يدفعان الروابط إلى الداخل فتقل الزاوية بين الروابط من 109.5o إلى 104o ويسمى الشكل الهندسي في هذه الحالة غير خطي أو منحنياً هرمي or V-shaped Bent
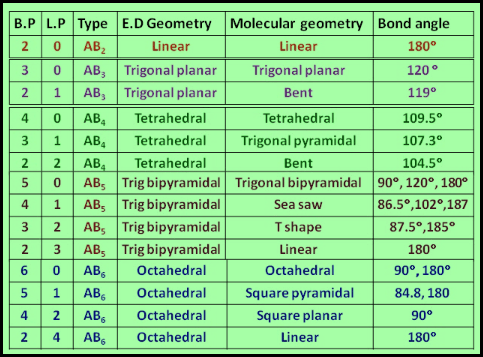
ملخص الشكل الهندسي للجزيء والزاوية بين الروابط
ويمكن تلخيص ماسبق فى هذه الجداول كما يلي:
المراجع: مبادئ الكيمياء العامة (نظري – مسائل محلولة). محي الدين البكوش – نوري بسيبسو – ياسر حورية – نبيل شيخ قروش، الطبعة الثانية (2003م) / شركة الجا للنشر العلمي – طرابلس.





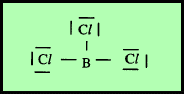

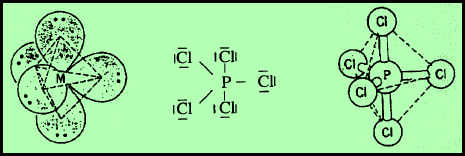
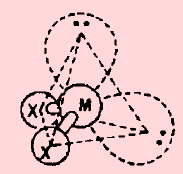
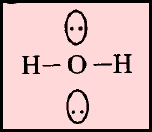


مختصر وجميل شكرا
شكراً لك عزيزتى ومرحباً بك في موقعنا دائماً
شكرا لكم
شكراً لك عزيزي ومرحباً بك في موقعنا دائماً
الشكل الهندسي واطوال الاواصر والزوايا لغاز CHCl3
الشكل الفراغى يكون رباعى الأوجه والزاوية بين الروابط التساهميه فى الجزئ 109.5
مشكورين
شكراً لك عزيزي ومرحباً بك في موقعنا دائماً
الشكل الفراغى لHCN