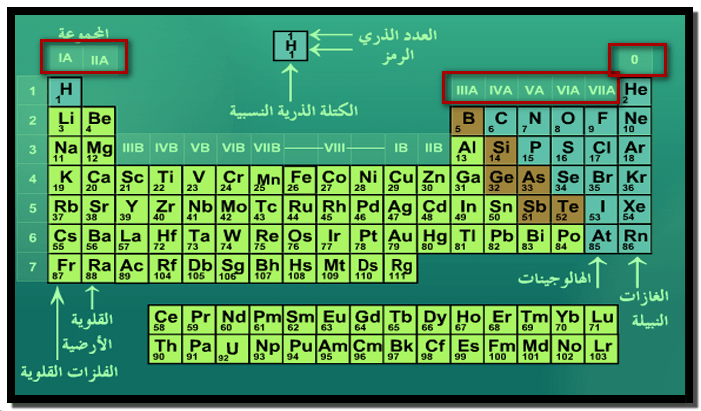
مجموعات الجدول الدوري للعناصر Periodic table groups
الجدول الدوري
الدورات Periods
– يتكون الجدول الدوري من سبع صفوف أفقية (Horizontal Rows) تسمي بالدورات (Periods).
– تترتب فيه عناصر الجدول الدوري حسب الزيادة في العدد الذري من اليسار إلى اليمين.
– تبدأ كل دورة بذرة عنصر تمتلك إلكتروناً واحداً فقط في غلافها التكافئي وتنتهي بذرة عنصر تمتلك غلاف تكافئياً تاماً.
– توصف الدورات الثلاث الأولي بالدورات القصيرة حيث تتشكل من 2,8,8 عناصر على التوالي،
– الدورة الرابعة والخامسة تتشكل كل منها من 18 عنصراً
– أما الدورة السادسة فتتشكل من 32 عنصراً
– بينما الدورة السابعة تتشكل من 22 عنصراً ، أغلب عناصر الدورة السابعة عناصر مشعة غير طبيعية.
المجموعات groups
– يتكون الجدول الدوري من ثمانية عشر صفاً عمودياً تسمي بالمجموعات (Groups).
– ثمانية مجموعات رأسية وعشرة فرعية عناصر تتشابه في خواصها الكيميائية
– توصل الاتحاد العالمي للكيمياء النظرية والتطبيقية IUPAC عام 1984م إلى اعتماد الأرقام العربية (1,2,3,4,…..) بدلاً من الأرقام الرومانية (I,II,III,IV,…..) في ترقيم المجموعات.
وأن شاء الله سوف نشرح في هذا الموضوع المجموعات الثمانية الرئيسية وهي:

(1) العناصر
القلوية Alkali
metals
** هي عناصر لينة ذات درجات
حرارة انصهار منخفضة وكثافة منخفضة.
** لها ميل شديد لتكوين أيونات موجبة أحادية.
** تتفاعل بشدة مع أوكسجين الهواء وتزداد فاعليتها ابتداء من
الليثوم إلى السيزيوم بازدياد العدد الذري.
** تفاعلها مع الماء شديد جداً .القواعد الناتجة عن هذا
التفاعل قواعد قوية.
** عناصر هذه المجموعة عوامل مختزلة قوية.
** تفقد بريقها عند تعرضها للهواء.
(2) العناصر القلوية الترابية alkali earth metals
المجموعة IIA: Ra , Ba , Sr , Ca , Mg , Be
** عناصر أكثر صلابة وأكثر
كثافة من العناصر القلوية (عناصر المجموعة IA).
** تكون أيونات ثنائية الشحنة موجبة بسهولة غير أن فاعليتها
أقل من فعالية العناصر القلوية.
** هيدروكسيداتها قليلة الذوبان فى الماء. باستثناء Ba(OH)2 فهو معتدل الذوبان فى
الماء.
** هيدروكسيداتها ذات قوى قاعدية متوسطة.
(3) مجموعة البورون Boron group
** لجميع لهذة العناصر ميل
لتكوين ايونات ثلاثية الشحنة الموجبة بالرغم من أن الأيون B+3 عديم الأستقرار الا انه تعرف له مركبات
عديدة بحالة التأكسد هذه.
** أكاسيد هذة المجموعة لها صفات حامضية وأخري قاعدية.
(4) مجموعة الكربون Carbon group
A: Pb , Sn , Ge ,
Si , C
** عناصر هذه المجموعة لها
ميل لتكوين حالة التأكسد +4 وللكربون ميل أضعف لتكوين
حالة التأكسد هذه، في حين يكون الرصاص ميل شديد لتكوينها.
** الرصاص في هذه المجموعة هو العنصر الفلزي. وهذا مثال واضح
لما سبق ذكره بأن الصفات الفلزية تزداد نزولاً فى المجموعة الواحدة، أي بازدياد
العدد الذري.
** الكربون فى هذه المجموعة عنصر لا فلزي.
** السيلكون والجرمانيوم أشباه فلزات.
** الصفات اللافلزية الوحيدة للقصدير هي في أحدي صورة المسماة
بالقصدير الرمادي.
** أكاسيد العناصر الأثقل هي ذات صفات أمفوتيرية.
(5) مجموعة النيتروجين Nitrogen group
** تحتوي هذه المجموعة على
عنصر فلزي واحد هو البزموث الذي يعد من أثقل عناصر مجموعته.والنيتروجين والفوسفور
من العناصر اللافلزية. أما الزرنيخ والأنتيمون من أشباه الفلزات.
** تتراوح حالات تأكسد هذه المجموعة بين -3 إلى +5.
** لأكاسيد النيتروجين والفوسفور والزرنيخ صفات حامضية تتناقص
حسب ازدياد العدد الذري لهذه العناصر الثلاثة أما أكسيد الأنتيمون والبزموث فهما
متغيران.
(6) مجموعة الأكسجين Oxygen group
A: Po , Te , Se ,
S , O
** تحتوي هذه المجموعة على
ثلاث عناصر لا فلزية هي الأكسجين والكبريت والسلينيوم وتحتوي على عنصرين من أشباه
الفلزات هما عنصري التوليريوم والبولونيوم.
** حالات التأكسد لهذه العناصر تتراوح بين -2 إلى +6 .
** أكاسيد الكبريت والسلينيوم أكاسيد حمضية أما أكاسيد
التوليريوم فهي أكاسيد أمفوترية.
(7) مجموعة الهالوجينات Halogens groups
** جميع عناصر هذه المجموعة
ذات صفات لا فلزية قوية.
** جميع عناصر هذه المجموعة عناصر فعالة وأكثرها فعالية هو
الفلور.
** هايدريداتها ذات صفات حامضية.
** تعتبر الأحماض HI , HBr , HCl من الأحماض القوية ، بينما يعتبر HF ذو صفات حامضية معتدلة.
** أكاسيد الكلور والبروم واليود ذات صفات حامضية.
** عناصر هذه المجموعة عوامل مؤكسدة جيدة وتتفاعل بشدة مع
الفلزات، وتستطيع إزاحة أغلب اللافلزات الأخرى من مركباتها.
(8) مجموعة الغازات النبيلة zero group
: Rn , Xe , Kr , Ar , Ne , He
** عناصر خاملة كيميائياً
تقريباً وفي الآونة الأخيرة أمكن تحضير بعض مركبات العناصر ذات الأعداد الذرية
العالية منها.
** جزئيات هذه العناصر أحادية الذرة بخلاف ما عليه في الغازات
الأخرى حيث تكون جزئيات ثنائية الذرة.
** القوي التى تفصل ذرات هذه العناصر ضعيفة جداً. ومقارنة فهي
أقوي ما يمكن بين ذرات الرادون ، لكنها بين ذرات الهيليوم أضعف ما يمكن.ولهذا
السبب يصعب تكثيف هذه الغازات
** يوصف سلوكها عند الظروف العادية من ضغط ودرجة الحرارة بالمعادلة
العامة للغازات المثالية.
التشابه القطري فى الجدول الدوري
تعريف التشابه القطري
الكيميائي والفيزيائي، فقد وجد أن لعناصر الدورة الثانية وخاصة عناصر B , Be , Li صفات كيميائية تشابه الصفات الكيميائية للعنصر
الثاني في المجموعة التى تليه ويعرف مثل هذا التشابه بالتشابه القطري كما يلي:
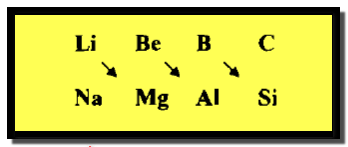
سبب هذا التشابه القطري
تقريباً، والجهد الأيوني أو ما يسمى بكثافة الشحنة Charge density هو عبارة عن نسبة شحنة الأيون إلى نصف
قطره.
– فمثلاً أن نصف قطر أيون البريليوم يساوي 0.31 أنجستروم وأن جهده
الأيوني يساوي 6.4 وهذا الجهد يساوي تقريباً
الجهد الأيوني للألمونيوم +3/0.5 = 6.0 ولهذا السبب تتشابه الصفات
الكيميائية إلى حد ما لهذين العنصرين.
– كما تتشابه الصفات الكيميائية لعنصري
البورون والسيلكون لنفس السبب وكذلك لعنصري الليثيوم والماغنسيوم.
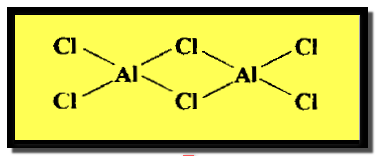
الدليل على هذا التشابه القطري
الماغنسيوم فية ، في حين أن بقية كلوريدات عناصر مجموعة الليثيوم لا تذوب في
الكحول الأيثيلي.
الصلبة المتطايرة ، يكونان في طورهما البخاري جزئيات بوليمرية ثنائية Dimers (Al2Cl6 , Be2H4)ذات تركيب جسري في حين أن بقية كلوريدات عناصر
المجموعة الثانية لا تكون هذا التركيب الجسري وتنصهر في درجات الحرارة العالية.
المراجع
لأولى / دار الفجر للنشر والتوزيع – القاهرة – جمهورية مصر العربية