نظريات عمل الأدلة المستخدمة فى تفاعلات معايرات التعادل
محتويات الموضوع
نظريات عمل الأدلة المستخدمة فى تفاعلات معايرات التعادل
– تم وضع ثلاثة من نظريات عمل الأدلة المستخدمة فى تفاعلات معايرات التعادل Theories of Indicator Behaviour وهي كما يلي:
(1) النظرية الأيونية Ionic Theory
(2) النظرية الكروموفورية The Chromophoric Theory
(3) النظرية الأيونية الكروموفورية Ionic – Chromophoric Theory
(1) النظرية الأيونية Ionic Theory
– بدأت أول محاولات لتفسير عمل الدليل من قبل العالم أوستوالد Ostwald في عام 1819م.
– عرف العالم أوستوالد الدليل بأنه عبارة عن حمض أو قاعدة عضوية ضعيفة يكون لونها في حالتها المتأينة مختلفاً عن لونها فى حالتها غير المتأينة.
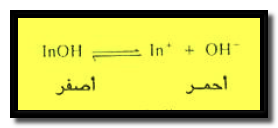
– قد رمز إلى الدليل الحامضي غير المتأين بالرمز (HIn) والدليل القاعدي غير المتأين بالرمز (InOH)
– يكون الاتزان الأيوني الممكن حدوثه فى المحاليل المائية لهذه الأدلة كما يلي:
دليل الفينول فثالين
– فمثلاً يتأين دليل الفينول فثالين الذي يعتبر حمض عضوي ضعيف على الصورة الآتية كما يلي:
– فلو أضيف إلى محلوله حمض فإن التفاعل يسير إلى اليسار نتيجة لزيادة تركيز أيون الهيدروجين أي أن الدليل سيكون في شكله الجزيئي عديم اللون في الوسط الحامضي.
– أما إذا أضيفت إليه قاعدة فإن التفاعل يسير نحو اليمين وبذلك يكون الدليل في شكله القاعدي المتأين الأحمر اللون.
دليل عباد الشمس
– وكمثال آخر يعتبر دليل عباد الشمسLitmus حمض عضوي ضعيف ويكون لون صورته الحامضية أحمراً ولون صورته القاعدية أزرقاً ويتأين كما يلي:
– ويكون لون محلول الدليل في الماء وسطاً بين اللونين أي بنفسجياً وعند إضافة حمض إلية ينزاح الاتزان إلى اليمين ويظهر الدليل بلونه الحمر.
– أما عند إضافة قاعدة إلى محلوله فإن الاتزان ينزاح إلى اليمين ويظهر الدليل بلونه الأزرق.
– ويعتبر عباد الشمس من الأدلة ذات اللون الواحد لأن صورتيه ملونتان أما دليل الفينول فثالين فهو من الأدلة ذات اللونين لأن صورته القاعدية فقط هي الملونة.
دليل الميثيل البرتقالي
– طبقاً للنظرية الأيونية فإن الأدلة القاعدية مثل الميثيل البرتقالي تتأين حسب المعادلة كما يلي:
وبإضافة حمض إلى المحلول فإن التفاعل يسير نحو اليمين ، ويكون لون الدليل أحمراً فى الوسط الحامضي وأصفراً في الوسط القاعدي.
(2) النظرية الكروموفورية The Chromophoric Theory
– النظرية الكروموفورية هي أحد نظريات عمل الأدلة المستخدمة فى تفاعلات معايرات التعادل المهمة.
– يتضح مما سبق أن النظرية الأيونية للأدلة قد تمكنت من تقديم تفسير لتغير لون الدليل عند إضافة أيون الهيدروجين أو أيون الهيدروكسيل على محلول الدليل.
– لا تستطيع النظرية الأيونية تفسر سلوك كل الأدلة، فقد وجد أن لون الأدلة يعتمد على تركيب جزيئاتها وأن التغير في لون الدليل يكون نتيجة لتغير في تركيب جزيئاته وإعادة ترتيب الروابط بين الذرات في جزئ الدليل.
– طبقاً لهذه النظرية فلابد من وجود مجموعات كروموفورية Chromophoric groups يعزي لها لون الدليل نتيجة إعادة الترتيب في تركيب جزيئاتها.
– من أمثلة المجموعات الكروموفورية مايلي:
مجموعة النيترو
– مجموعة النيترو التى يمكن تحويلها تحت ظروف معينة إلى الصورة الآتية كما يلي:
مجمـوعة الأزو ( -N = N- ) التى يمكن تحويلها إلى ( =N – NH- ).
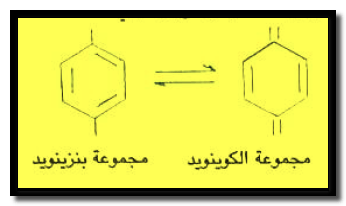
مجمـوعة الكوينويد وهي من أهم المجموعات الكروموفورية والتي تنتج من تحول مجموعة بنزينويد كما هو موضح فيما يلي:
مجموعة الكربونيل
– مجموعة الكربونيل ( >C=O ) والتى تتحول تحت ظروف معينة إلى مجموعة أينول enol كما هو موضح:
– قد تكون المجموعة الكروموفورية عبارة عن عدد من الروابط المضاعفةdouble bonds المتناوبة.
– يتأثر لون المركب العضوي الذي يحتوي على المجموعة الكروموفورية بوجود مجموعات أخري تسمى بالمجموعات المزودة للون (auxochromes) لأن وجودها يزيد من شدة اللون الناتج من المجموعات الكروموفورية.
– من الأمثلة عليها مجموعات الهيدروكسيل والأمين والميثوكسي (-OCH3) وثاني ميثيل الأمين.
– تبعاً للنظرية الكروموفورية فإن التغير في لون الدليل يعزي إلى التغير في الصور الإيزوميرية لجزئ الدليل. أي بتغير ترتيب الروابط وبالتالي المجموعات في جزئ الدليل.
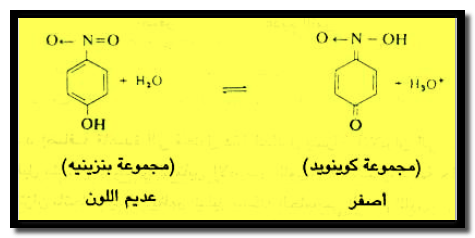
– فمثلاً يمكن تمثيل التغير الذي يحدث في تركيب جزئ دليل البارانيتروفينول بالكيفية الآتية كما يلي:
– يعزي ظهور اللون الأصفر إلى تغير المجموعة البنزينية عديمة اللون إلى مجموعة الكوينويد ذات اللون الأصفر.
(3) النظرية الأيونية الكروموفورية Ionic – Chromophoric Theory
– النظرية الأيونية الكروموفورية هي النظرية الأخيرة من نظريات عمل الأدلة المستخدمة فى تفاعلات معايرات التعادل.
– لقد لوحظ أن تغير لون الدليل يرتبط بتغير تركيب جزيئاته، وأن تركيب جزئيات الدليل يتغير بإضافة حمض أو قاعدة إلى محلول الدليل.
– قد يبدو لأول وهلة أن النظرية الأيونية والنظرية الكروموفورية تعطي كل منهما تفسيراً مختلفاً لعمل الأدلة ولكنهما فى الحقيقة مكملتان لبعضهما البعض.
– بالإضافة إلى ذلك فأنه بدمج النظرية الأيونية مع النظرية الكروموفورية يمكن تقديم شرح واف لعمل الأدلة.
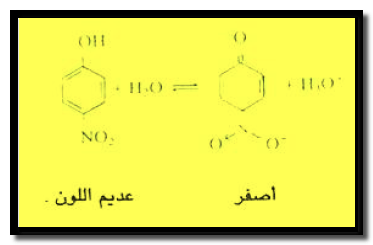
– طبقاً لذلك فإنه يوجد اتزان بين جزئيات الدليل المتعادلة وجزئياته بشكلها الحمضي كما يوجد اتزان بين جزئيات الدليل بشكلها الحمضي وأيوناته بشكلها القاعدي كما هو موضح بالنسبة لدليل البارانيتروفينول.
دليل البارانيتروفينول
– عند إضافة قاعدة إلى محلول هذا الدليل ينزاح الاتزان إلى اليمين ويظهر الدليل بشكله القاعدي المتأين الأصفر اللون.
– أما عند إضافة حمض فينزاح الاتزان باتجاه اليسار ويظهر الدليل بشكله الحمضي العديم اللون.
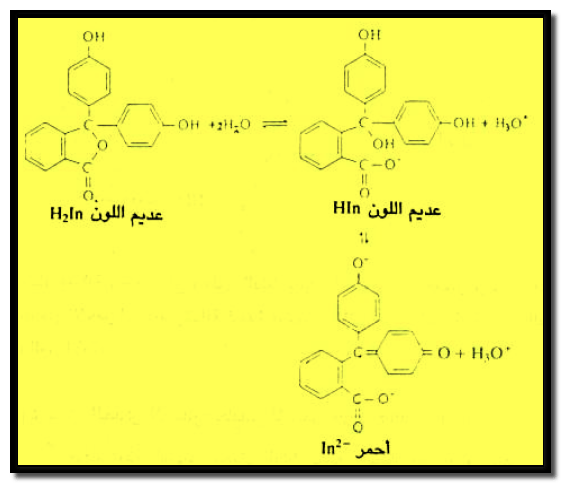
دليل الفينول فثالين
– كمثال آخر يعتبر دليل الفينول فثالين من الأحماض العضوية الضعيفة ويتأين كما يلي:
– ويظهر من الاتزان السابق أن نواة بنزين واحدة فقط قد تحولت إلى مجموعة كوينويد في جزئ الفينول فثالين.
– عند إضافة قاعدة فإن الأتزان ينزاح إلى اليمين ويظهر الدليل باللون الأحمر.
– أما عند إضافة حمض فإن الأتزان ينزاح إلى اليسار ويظهر الدليل عديم اللون.
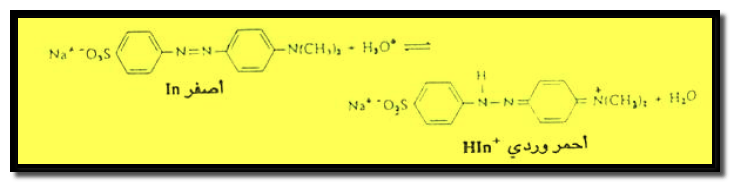
دليل الميثيل البرتقالي
– أما دليل الميثيل البرتقالي الذي يعتبر قاعدة ضعيفة، فهو جزئ متردد (Amphoteric) لأنه يحتوي على مجموعة السلفونيك ( -SO3H) الحمضية ومجموعة ثنائي الأمين (–N(CH3)2) القاعدية.
– يتأين جزئ الميثيل البرتقالي مكوناً أيونات مترددة تحمل شحنة موجبة وشحنة سالبة تبعاً لحموضة الوسط.
– فهو في الوسط القاعدي ذو لون أصفر، وفي الوسط الحامضي ذو لون أحمر.
– يتأين هذا الدليل على النحو الآتي كما يلي:
– عند إضافة حمض إلى محلول الدليل ينزاح الأتزان إلى اليمين ويظهر الدليل باللون الأحمر.
– أما عند إضافة قاعدة فينزاح الاتزان إلى اليسار ويظهر الدليل باللون الأصفر.