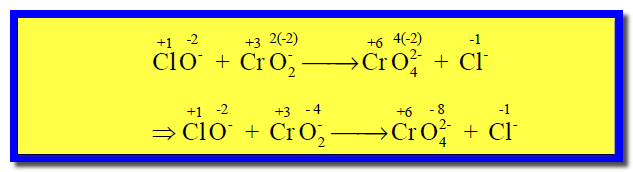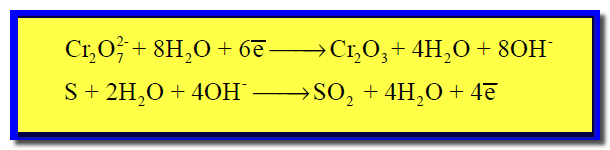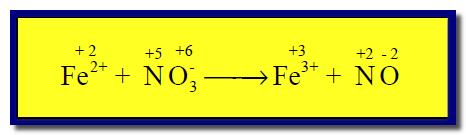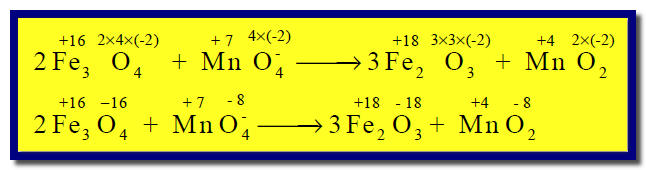وزن معادلات الأكسدة والاختزال Redox equations
محتويات الموضوع
وزن معادلات الأكسدة والاختزال
تتم عملية وزن معادلات الأكسدة والاختزال بطريقتين كما يلي:
(1) طريقة الأيون – إلكترون (طريقة نصف التفاعل)
(Ion – Electron (Half Reaction Method
(2) طريقة أعداد الأكسدة
Oxidation numbers Method
وزن معادلات الأكسدة والاختزال بطريقة الأيون – إلكترون (طريقة نصف التفاعل)
– نتبع الخطوات الآتية لوزن معادلات الأكسدة والاختزال بطريقة الأيون – إلكترون (طريقة نصف التفاعل) كما يلي:
(1) تحديد أعداد الأكسدة لجميع الذرات، ومنها يحدد العنصر الذي تأكسد والعنصر الذي اُختزل.
(2) وزن الذرات التى حصل لها أكسدة واختزال من خلال مقارنة أعداد الأكسدة للذرات. وإذا كانت هذه الذرات موزونة ننتقل للخطوة التالية مباشرة.
(3) كتابة نصفي تفاعل الأكسدة والاختزال كل على حدة.
(4) وزن الأكسجين وذلك بإضافة جزئ ماء عن كل ذرة أكسجين ناقصة.
(5) وزن الهيدروجين كما يلي:
(أ) في الوسط الحامضي يوازن النقص فى ذرات الهيدروجين بإضافة أيون هيدروجين (H+) عن كل ذرة هيدروجين ناقصة.
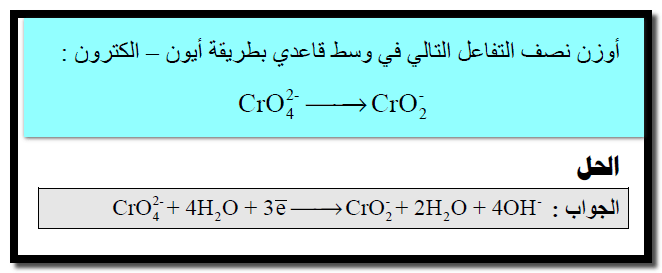
(ب) فى الوسط القاعدي يوازن النقص في ذرات الهيدروجين بإضافة جزئ ماء (H2O) عن كل ذرة هيدروجين ناقصة وفى الجهة الأخرى يضاف أيون هيدروكسيد (OH–)عن كل جزئ ماء تمت إضافته.
(6) نوازن الشحنات وذلك بإضافة إلكترونات إلى كل نصف على حدة.
(7) توحيد عدد المعامل الحسابي للإلكترونات فى حالة عدم تساوي عدد الإلكترونات المفقودة مع المكتسبة بحيث نضرب كل نصف تفاعل في عدد ما بحيث تتساوى أعداد الإلكترونات المفقودة والمكتسبة.
(8) نجمع نصفي التفاعل بعض التخلص من الإلكترونات في كلا المعادلتين.
مسائل محلولة على وزن معادلات الأكسدة والاختزال بطريقة الأيون – إلكترون
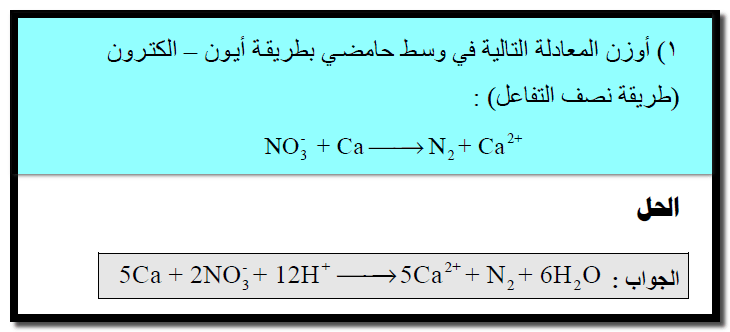
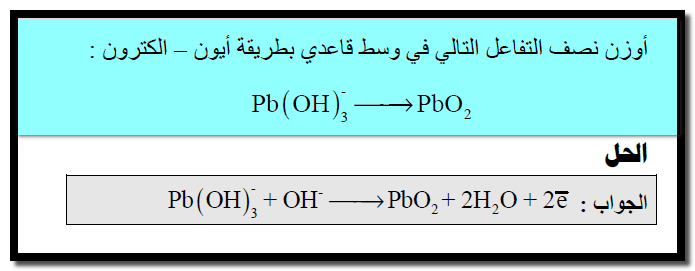
مثال (1)
الحل:
(1) نوجد عدد الأكسدة لجميع الذرات فى المعادلة كما يلي:
نلاحظ أن عدد الذرات التى حدث لها أكسدة واختزال موزونة على طرفي المعادلة.
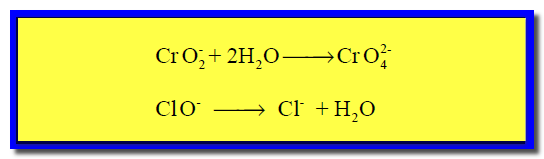
(2) كتابة تفاعل الأكسدة والاختزال كما يلي:
(3) نزن الأكسجين بإضافة جزئ ماء عن كل ذرة أكسجين ناقصة إلى الطرف الناقص كما يلي:
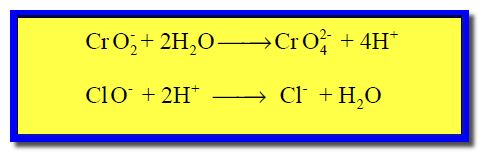
(4) نوزن الهيدروجين بإضافة أيون (H+)عن كل ذرة هيدروجين ناقصة كما يلي:
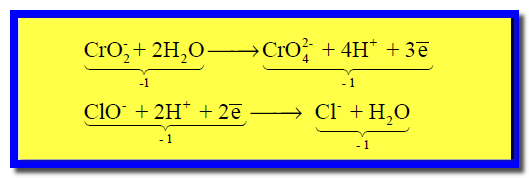
(5) نوزن الشحنات بإضافة إلكترونات إلى كل نصف على حدة كما يلي:
(6) توحيد المعامل الحسابي للإلكترونات كما يلي:
(7) نجمع نصفي التفاعل بعد التخلص من الإلكترونات فى كلا المعادلتين كما يلي:
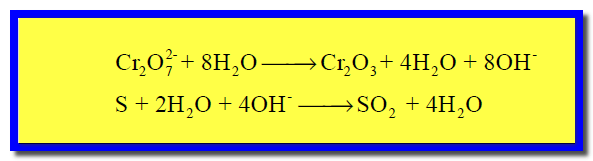
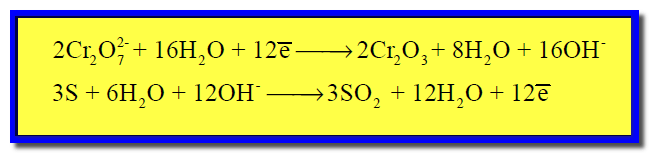
مثال (2)
الحل :
(1) إيجاد عدد الأكسدة لجميع الذرات فى المعادلة كما يلي:
(2) كتابة نصفي تفاعل الأكسدة والاختزال كل على حدة كما يلي:
(3) وزن الأكسجين بإضافة جزئ ماء عن كل ذرة أكسجين ناقصة كما يلي:
(4) وزن الهيدروجين بإضافة جزئ ماء عن كل ذرة هيدروجين ناقصة، وفي الجهة الأخري يضاف أيون الهيدروكسيد عن كل جزئ ماء تمت إضافته:
(5) نوزن الشحنات وذلك بإضافة إلكترونات إلى كل نصف على حدة:
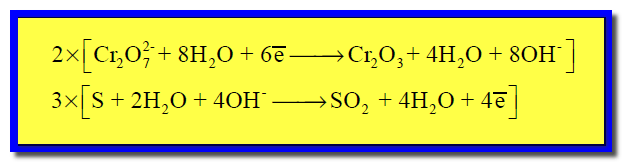
(6) توحيد المعامل الحسابي للإلكترونات كما يلي:
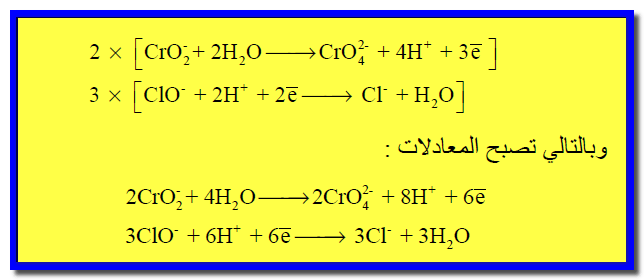
وبالتالي تصبح المعادلات بعض ضربها فى المعامل الحسابي كما يلي:
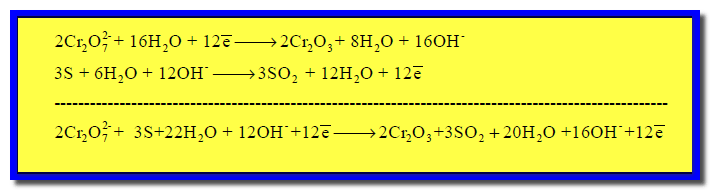
(7) نجمع نصفى التفاعل كما يلي:
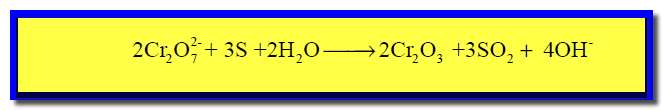
(8) نختصر المتكرر فى الطرفين كما يلي:
مثال (3)
مثال (4)
مثـال (5)
مثال (6)
مثال (7)
مثـال (8)
مثال (9)
مثال (10)
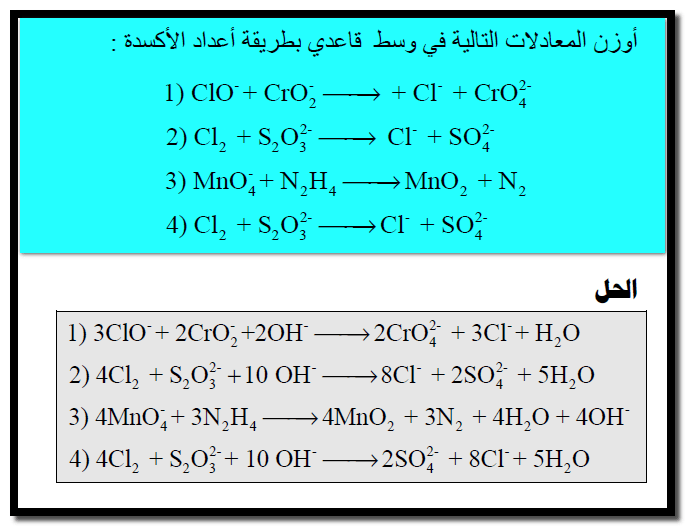
وزن معادلات الأكسدة والاختزال بطريقة أعداد الأكسدة
– نتبع الخطوات الآتية لوزن معادلات الأكسدة والاختزال بطريقة أعداد الأكسدة كما يلي:
(1) وزن الذرات (باستثناء الهيدروجين والأكسجين)التى حصل بها أكسدة واختزال إذا كانت غير موزونة.
(2) تحديد أعداد الأكسدة لجميع الذرات فى التفاعل. ومن هنا سوف يتبين العنصر الذي حدث له أكسدة والعنصر الذي حدث له اختزال.
(3) صل العنصر الذي حدث له أكسدة مع ناتج تأكسده، واكتب على الخط عدد الإلكترونات المفقودة. وصل العنصر الذي حدث له اختزال مع ناتج اختزاله بخط واكتب على الخط عدد الإلكترونات المكتسبة.
(4) وحد عدد المعامل الحسابي للإلكترونات في حالة عدم تساوي عدد الإلكترونات المفقودة مع المكتسبة
(5) يوازن النقص في ذرات الأكسجين بإضافة جزئ ماء عن كل ذرة أكسجين ناقصة.
(6) يوازن النقص فى ذرات الهيدروجين حسب الوسط كما يلي:
(أ) فى الوسط الحامضي يوازن النقص فى ذرات الهيدروجين بإضافة أيون هيدروجين(H+)عن كل ذرة هيدروجين ناقصة.
(ب) في الوسط القاعدي يوازن النقص فى ذرات الهيدروجين بإضافة جزئ ماء (H2O) عن كل ذرة هيدروجين ناقصة وفى الجهة الأخرى يضاف أيون الهيدروكسيد عن كل جزئ ماء تمت إضافته.
(7) نختصر المتكرر فى المواد المتفاعلة والناتجة.
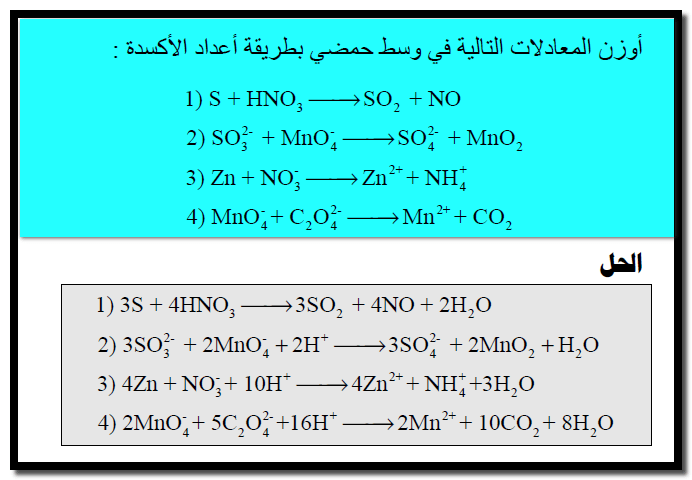
مسائل محلولة على وزن معادلات الأكسدة والاختزال بطريقة أعداد الأكسدة
مثال (1)
الحل:
(1) من المعادلة المعطاة في السؤال فإن الذرات التي حصل بها أكسدة واختزال موزونة
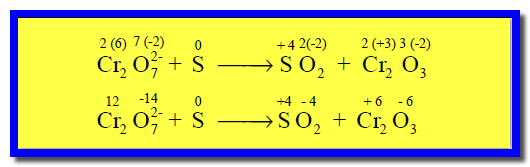
(2) نحدد أعداد الأكسدة لجميع الذرات كما يلي:
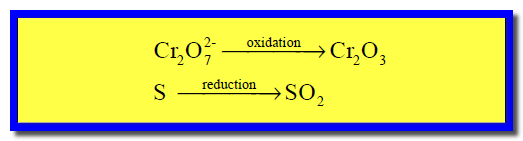
ونلاحظ أن الحديد قد زاد رقم الأكسدة له من (+2) إلى (+3) وبالتالي حدث له أكسدة، وبالمقابل فإن النيتروجين نقص عدد الأكسدة له من (+5) إلى (+2) مما يعنى حدوث عملية اختزال له.
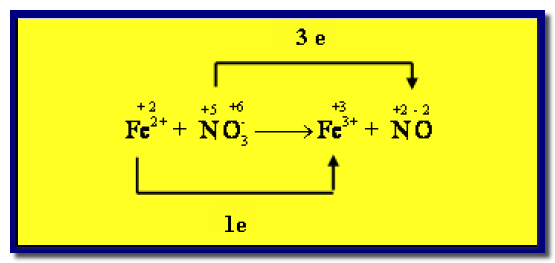
(3) نصل بخط بين (Fe+2)الذي حصل له أكسدة مع ناتج الأكسدة (Fe+3)مع كتابة عدد الالكترونات المفقودة، ونصل بين(NO3–) الذي حدث اختزال مع ناتج الاختزال (NO) بخط مع كتابة عدد الإلكترونات المكتسبة على الخط.
(4) نساوي عدد الإلكترونات بضرب المواد المشتركة فى الأكسدة فى العدد 3 وبضرب المواد المشتركة فى الاختزال فى العدد 1.
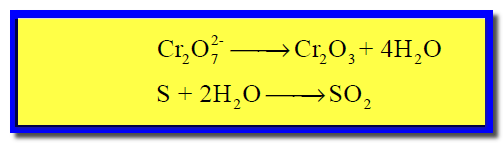
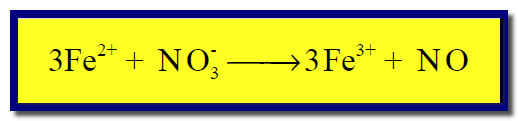
(5) نوزن النقص فى ذرات الأكسجين بإضافة جزئ ماء عن كل ذرة أكسجين ناقصة كما يلي:
(6) نوزن النقص في ذرات الهيدروجين بإضافة(H+)عن كل ذرة هيدروجين ناقصة كما يلي:
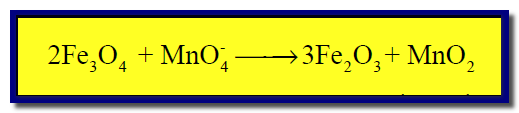
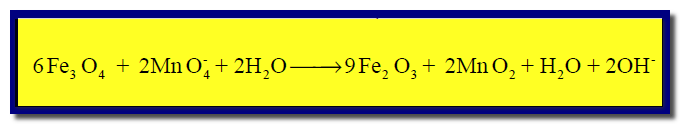
 مثال (2)
مثال (2)
الحل :
(1) نزن الذرات التى يحصل بها أكسدة واختزال (باستثناء ذرات الهيدروجين والأكسجين) كما يلي:
(2) نوجد إعداد الأكسدة لجميع الذرات كما يلي:
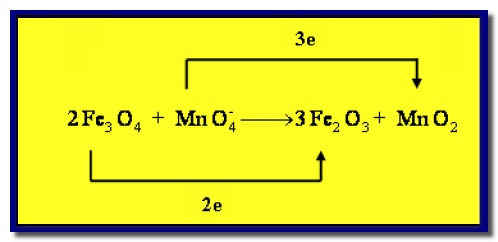
(3) نصل بين المادة التى حصل لها أكسدة (Fe3O4) مع ناتج الأكسدة (Fe2O3) مع كتابة عدد الإلكترونات المفقودة (–2e)، ونصل المادة التى حصل لها اختزال (MnO4–)مع ناتج الإختزال (MnO2) مع كتابة عدد الإلكترونات المكتسبة (–3e)
(4) نضرب عدد الإلكترونات المشتركة فى الأكسدة في (3) ونضرب المواد المشتركة فى الإختزال فى (2) كما يلي:
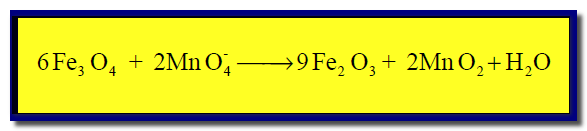
(5) نوزن النقص في ذرات الأكسجين بإضافة جزئ ماء عن كل ذرة أكسجين ناقصة كما يلي:
(6) نوزن النقص في ذرات الهيدروجين بإضافة جزئ ماء (H2O) عن كل ذرة هيدروجين ناقصة وفي الجهة الأخرى يضاف أيون الهيدروكسيد (OH–)عن كل جزئ ماء تمت إضافته كما يلي:
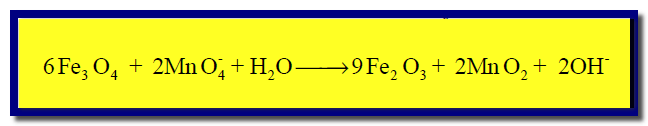
(7) بحذف المكرر فى المواد المتفاعلة والناتجة نحصل على:
مثال (3)
 مثال (4)
مثال (4)
المراجع: وزن معادلات الأكسدة والاختزال Redox reactions – الفصل الأول “الأكسدة والأختزال” من كتاب الكيمياء الكهربية – الجزء الأول للمؤلف / عمر بن عبدالله الهزازي أستاذ قسم الكيمياء – كلية العلوم التطبيقية – جامعة أم القرى.