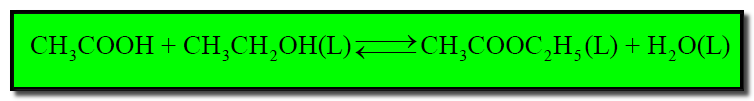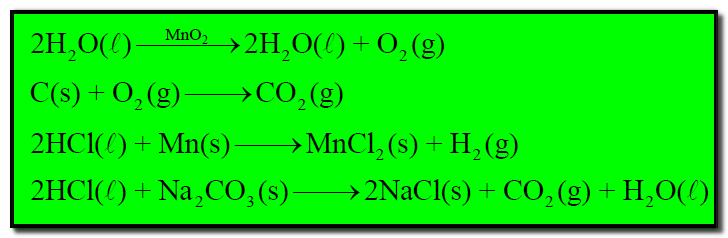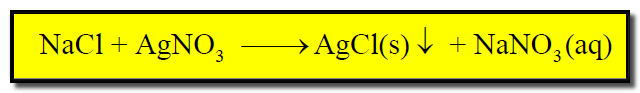أنواع التفاعلات الكيميائية Types of chemical reactions
– في هذا الموضوع سيتم مناقشة أنواع التفاعلات الكيميائية Types of chemical reactions بالتفصيل.
محتويات الموضوع
أولاً/ أنواع التفاعلات الكيميائية حسب حالة المواد المتفاعلة
– تقسم التفاعلات الكيميائية – حسب حالة المواد المتفاعلة – إلى قسمين وهما كما يلي:-
(1) التفاعلات المتجانسة Homogeneous Reactions
– التفاعلات المتجانسة هي التفاعلات التي تتم وتكون جميع مكوناتها فى حالة واحدة أو طور واحد ( تحدث في نظام يتكون من طور واحد).
– كما في التفاعلات الغازية والتفاعلات السائلة التى تحدث فى وجود مذيب لجميع المواد المتفاعلة.
– ومن الأمثلة التوضيحية للتفاعلات المتجانسة الأمثلة الآتية كما يلي:
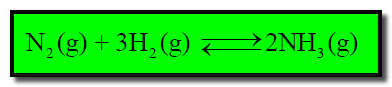
(أ) تفاعل غاز النيتروجين مع غاز الهيدروجين لتكوين غاز النشادر ( الأمونيا ) كما بالمعادلة التالية:
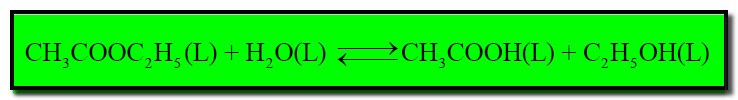
(ب) تفاعل (انحلال) خلات الإيثيل مع الماء لتكوين حمض الخليك والكحول الإيثيلي كما بالمعادلة التالية:
(جـ) تفاعل حمض الخل مع الكحول الإيثيلي لتكون خلات الإيثيل (عكس التفاعل السابق) كما بالمعادلة التالية:
(2) التفاعلات الغير المتجانسة Heterogeneous Reactions
– التفاعلات الغير المتجانسة هي التفاعلات التي تتم وتكون جميع مكوناتها موجودة بين طورين (أي حالتين) أو أكثر (التفاعلات التى تحدث فى نظام يتكون من طورين أو أكثر).
– وفي هذه الحالة يحدث التفاعل على السطح الفاصل بين الأطوار.
– ومن أمثلة هذا النوع من التفاعلات الغير المتجانسة التفاعلات الآتية كما يلي:
ثانياً/ أنواع التفاعلات حسب اتجاه التفاعل
(1) تفاعلات غير عكسية Irreversible Reactions
– التفاعلات الغير عكسية هى التفاعلات التى تسير فى اتجاه واحد فقط ، وهو اتجاه تكوين المواد الناتجة ، حيث لا تكون للمواد الناتجة – وتحت نفس ظروف التفاعل – القدرة على أن تتفاعل مع بعضها لتكون المواد الأصلية (المتفاعلة).
– ويمثل لهذه التفاعلات بسهم يشير رأسه إلى اتجاه المواد الناتجة كما يلي:
مواد ناتجة → مواد متفاعلة
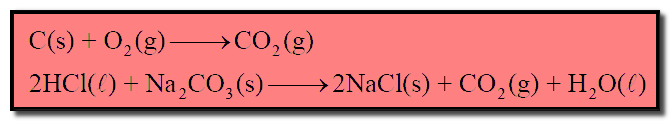
(2) تفاعلات عكسية Reversible Reactions
– التفاعلات العكسية هى التفاعلات التى تسير في اتجاهين (أمامي وخلفي) ، حيث تكون للمواد الناتجة القدرة على أن تتفاعل مع بعضها – وتحت نفس ظروف التفاعل – لتكون المواد الأصلية (المتفاعلة).
– ويرمز لهذه التفاعلات بسهمين لهما رأسان متضادان.
– ومن أمثلة التفاعلات العكسية التفاعلات الآتية كما يلي:
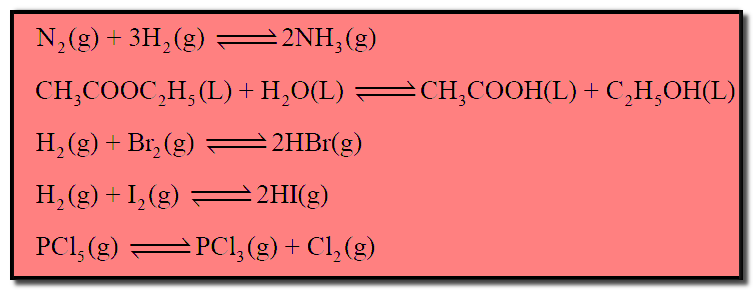
ثالثاً/ أنواع التفاعلات حسب سرعة (معدل) التفاعل
(1) تفاعلات سريعة جدًا Extremely fast reactions
– هذا النوع من التفاعل هو التفاعل الأيوني (تفاعلات أيونية تحدث فى الطبيعة ووقوعها لحظي).
– ومن أمثلة التفاعلات السريعة جداً التفاعلات الآتية كما يلي:
(أ) تفاعلات التعادل (أحماض قوية وقواعد قوية) في الأوساط المائية وتنتهي هذه التفاعلات فى خلال s 10-7
(ب) تفاعل كلوريد الصوديوم NaCl مع نترات الفضة AgNO3 ليعطي راسب كلوريد الفضة.
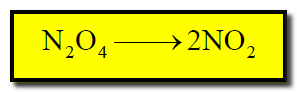
– بعض التفاعلات الغازية حيث من شدة السرعة لمعدل تفاعلاتها تحدث فرقعة كما فى تفكك مركب رابع أكسيد النتيروجين كما بالمعادلة الآتية:
(2) تفاعلات متوسطة السرعة Moderately slow reactions
– معظم سرعات هذه التفاعلات الكيميائية يمكن إدراكها، أى من المناسب قياسها معملياً، ومن هذه الأنواع عضوية وغير عضوية.
– ومن أمثلة التفاعلات متوسطة السرعة التفاعلات الآتية كما يلي:
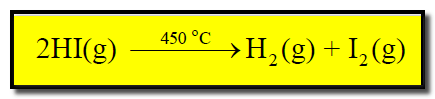
(أ) تفاعل تفكك يوديد الهيدروجين ليعطي هيدروجين ويود عند درجة حرارة (450oC).
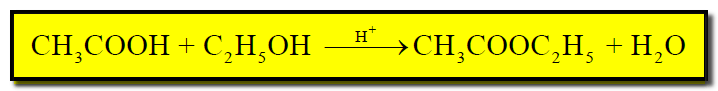
(ب) تفاعل الأسترة (تفاعل حمض عضوي مع كحول) عند درجة حرارة الغرفة.
(3) تفاعلات بطيئة جدًا Very slow reactions
– عديد من التفاعلات عند حدوثها لا يمكن إدراكها أو إحساسها عند درجة حرارة الغرفة ، ويمكن أن تكون ثيرموديناميكياً بأن (ΔGο) لها سالبة.
– ومن أمثلة ذلك الجازولين ، البنزين ، الغاز الطبيعي ، الفحم كلها مواد لا تحترق فى الهواء في درجة حرارة الغرفة إلا بواسطة الكبريت أو اللهب ، بحيث لو خلطنا البنزين والهواء فى أسطوانة موتور ثم يسلط علية لهب فإننا نلاحظ عند احتراقه فرقعة.
– عندما يخلط الأكسجين والهيدروجين لا يتكون أى كمية ولو بسيطة من الماء عند درجة حرارة الغرفة ولو تركت لأعوام.
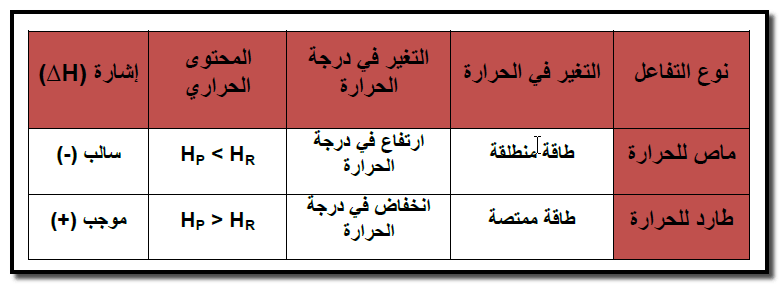
رابعاً/ أنواع التفاعلات حسب انطلاق أو امتصاص الحرارة.
(1) تفاعلات طاردة للحرارة Exothermic reactions
– التفاعلات الطاردة للحرارة هي التفاعلات الكيميائية التى يصاحبها انطلاق كمية من الطاقة الحرارية.
– ومن أمثلة التفاعلات الطاردة للحرارة التفاعلات الآتية كما يلي:
- تفاعل الاحتراق.
- تفاعل التنفس.
(2) تفاعلات ماصة للحرارة Exothermic reactions
– التفاعلات الماصة للحرارة هي التفاعلات الكيميائية التى يصاحبها امتصاص كمية من الطاقة الحرارية.
– ومن أمثلة التفاعلات الماصة للحرارة عملية البناء الضوئي.
المراجع : الفصل الأول ” التفاعل الكيميائي والعوامل المؤثرة عليه ” من كتاب الكيمياء الحركية kinetic chemistry للمؤلف / عمر بن عبدالله الهزازي أستاذ قسم الكيمياء – كلية العلوم التطبيقية – جامعة أم القرى