أثر درجة الحرارة على معدل سرعة التفاعل الكيميائي

تأثير درجة الحرارة على معدل سرعة التفاعل الكيميائي
– وجد من التجربة أن معدل سرعة تفاعل كيميائي ما، يتناسب طردياً مع درجة الحرارة التي يتم عندها التفاعل، وبالتالي فإن التفاعلات الكيميائية تسير بسرعات أكبر في درجات الحرارة العالية عنها في درجات الحرارة المنخفضة.
– أي أن درجة الحرارة تؤثر تأثيراً إيجابياً على معدل سرعة التفاعل بغض النظر عن كون التفاعل ماصاً أو طارداً للحرارة.
وهذا يعنى أنه كلما زادت درجـة الحرارة التي يتم عندها التفاعل زاد معدل سرعة التفاعل، وذلك طبقاً لقانون “فانت هوف”
– قانون (فانت هوف) ينص على:
(عند زيادة درجة الحرارة بمقدار عشر درجات مئوية فإن سرعة التفاعل الكيميائي تزداد بمقدار مرتين (الضعف) أو أربع مرات وفى المتوسط ثلاث مرات).
– يمكن تفسير أثر درجـة الحرارة بالقول أن ازدياد درجة الحرارة من شأنه أن يحرك الجزئيات بسرعات أكبر وتكون نسبة التصادمات المؤثرة والمؤدية إلى التفاعل كبيرة مما يزيد في سرعة التفاعل.
– عند درجات الحرارة المرتفعة تنتج نسب مئوية اكبر من التصادمات من تفاعل كيميائي لأن نسب مئوية أكبر من الجزئيات لها سرعة أكبر، وعلية تتوفر طاقة كافية للتفاعل.
أمثلة توضيحية توضح تأثير درجة الحرارة على معدل سرعة التفاعل الكيميائي
التفاعلات المتزنة وأثر درجة الحرارة
– إن تأثير الحرارة على التفاعلات المتزنة يعتمد على نوعية التفاعل هل هو طارد للحرارة أو ماص لها.
– فمثلاً تفاعل النيتروجين والهيدروجين لتكوين الأمونيا هو تفاعل طارد للحرارة:
– وحسب قاعدة لوشاتلييه فإن أي ارتفاع في درجـة الحرارة هذا التفاعل بمصدر خارجي كلهب مثلاً سيقاومه النظام بامتصاص جزء من الحرارة عن طريق تحلل جزء من الأمونيا إلى نيتروجين وهيدروجين وهو تفاعل ماص للحرارة.
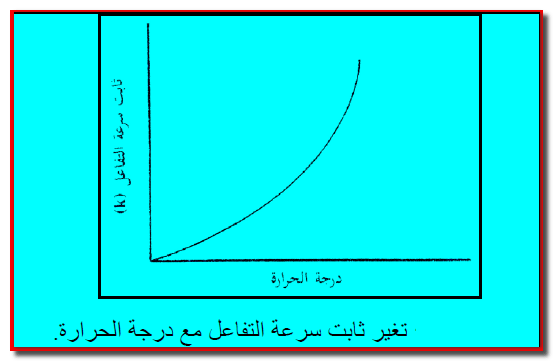
– وإذا أجري تفاعل كيميائي عند درجات حرارة مختلفة، فإنه عند رسم العلاقة بين درجة الحـرارة وثابت سرعة التفاعل K نحصل على الشكل التالي:
– ويعتبر هذا السلوك نموذجاً عاماً لمعظم التفاعلات الكيميائية وهو يدل على سرعة التفاعل تزداد بسرعة كتابع لدرجة الحرارة. ويلاحظ أن العلاقة غير خطية.
تفسير أثر درجة الحرارة على معدل سرعة التفاعل عن طريق النظرية الحركية للغازات
– ويمكن شرح تأثير درجة الحـرارة على سرعة التفاعلات الكيميائية عن طريق النظرية الحركية للغازات والتي تبرهن على أن (متوسط الطاقة الحركية لمجموعة من الجزئيات يتناسب طردياً مع درجات الحرارة المنطلقة).
– ولذلك فإن ارتفاع درجة الحرارة يزيد من عدد الجزئيات التي لديها طاقة حركية عالية جداً. وهذه الجزئيات العالية الطاقة يمكن أن تتفاعل عند تصادمها.
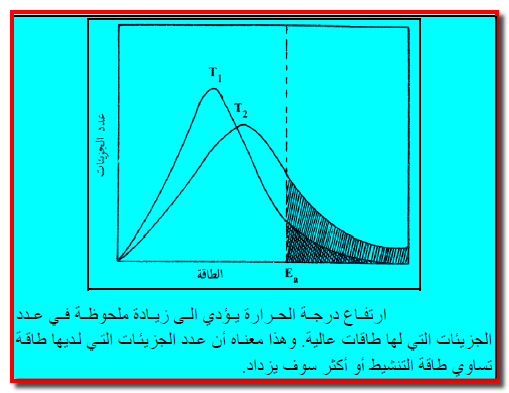
– فعند أي درجة حرارة (T1) يوجد عدد من الجزئيات يمتلك طاقة حركية متوسطة. والبعض الآخر لدية طاقة أقل أو أكثر من المتوسط عند تلك الدرجة. ل
– ذلك فإن عدداً محدوداً من الجزئيات عند هذه الدرجة لدية الطاقة الكافية للتفاعل. وهذه الطاقة تسمى “طاقة التنشيط” ويرمز لها بالرمز (Ea).
– وعند درجة حرارة أعلي (T2) فأن عدداً أكبر من الجزئيات سوف يكون لدية طاقة التنشيط اللازمة للتفاعل وبالتالي فإن التفاعل سوف يحدث بسرعة أكبر.
ويمكن إيضاح هذا التأثير بواسطة الشكل كما يلي:
ملاحظات على الشكل السابق:
– يوضح الشكل توزيع الطاقة الحركية بين الجزئيات عند درجتي الحرارة (T1) و (T2) حيث (T2) هي الأكبر.
– تمثل المساحة المظللة تحت المنحنين عدد الجزئيات التي لديها طاقة حركية تساوي طاقة التنشيط او أكثر.
– ملاحظة أن المساحة المظللة تحت المنحنين تكون أكبر عند درجات الحرارة العالية منها عند المنخفضة.
– طاقة التنشيط هي الطاقة اللازمة لتكسير الروابط الموجودة في الجزئيات المتفاعلة أو لتحرير الإلكترونات الخارجية كي تنتقل من ذرة إلى أخري.
1- سرعة التفاعل الكيميائي وطرق قياسها والعوامل المؤثرة عليها