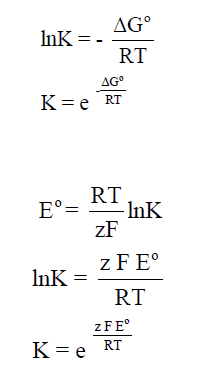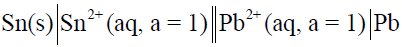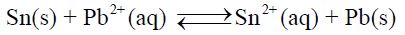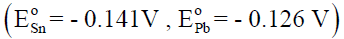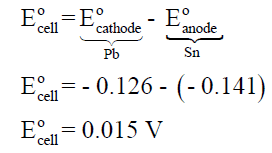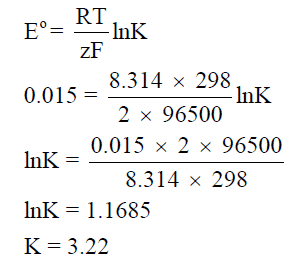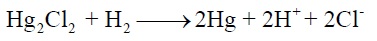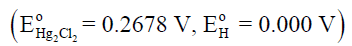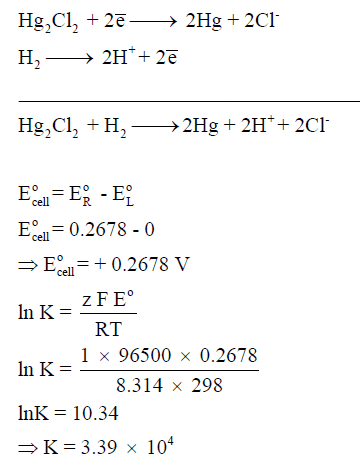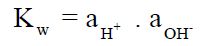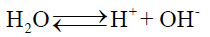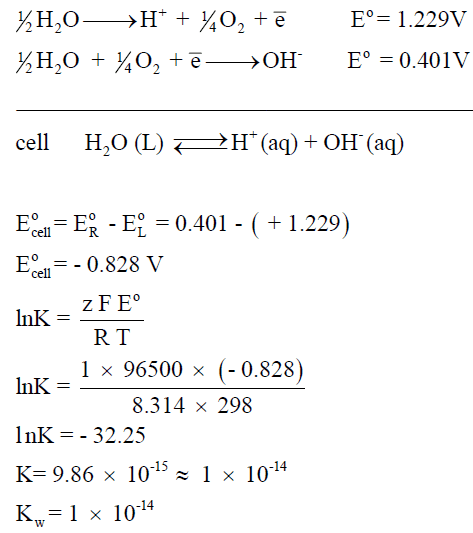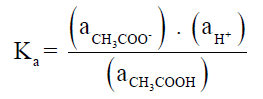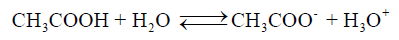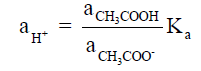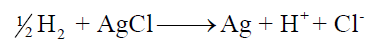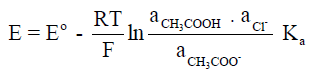– في هذا الموضوع سيتم مناقشة تقدير ثابت الاتزان عن طريق قياسات القوة الدافعة الكهربية وكذلك تقدير ثوابت الاتزان المختلفة.
محتويات الموضوع
تقدير ثابت الاتزان Equilibrium Constant
– ثابت الاتزان (K) لأى تفاعل يمكن حسابه من قياسات القوة الدافعة الكھربائية للخلية وفقاً للعلاقات الآتية كما يلي:
– حيث (Eº) هى قيمة القوة الدافعة الكھربائية القياسية للخلية تحت الظروف القياسية (a = 1) ، وإذا تم معرفة (Eº) تحت ھذه الظروف يمكن حساب قيمة (K).
– وھذا يعني أن معرفة ثابت التوازن لتفاعل كيميائي معين ممكن من مجرد معرفة قيمة (Eº) أو (ق. د. ك) للخلية التي تؤدي إلي حدوث ذلك التفاعل الكيميائي.
مسائل محلولة لتقدير ثابت الاتزان عن طريق قياسات القوة الدافعة الكهربية
مثال (1): لديك الخلية الآتية كما يلي:
–
احسب ثابت الاتزان للتفاعل الـى كما يلي:
علماً بأن جهود الأختزال القياسية كما يلي:
الحل :
– نحسب أولاً جھد الخلية القياسي (القوة الدافعة الكھربائية) كما يلى:
– ولحساب ثابت الاتزان نتبع العلاقة كما يلي:
مثال (2): احسب ثابت الاتزان للتفاعل التالي:
علماً بأن جهود الأختزال القياسية كما يلي:
الحل:
– يمكن التوصل إلى أن التفاعل التالي هو عبارة عن نصفي تفاعل أكسدة واختزال كما يلي:
طريقة حساب ثابت الاتزان
وفيما يلي عرض يبين كيفية حساب قيمة ثوابت الاتزان بصورھا المختلفة بالاستفادة من قياسات ق. د. ك ، وسنلاحظ في كل الأحوال أن طريقة حساب ثابت التوازن تعتمد على:
(1) كتابة المعادلة الكيميائية للتوازن أولاً وقبل كل شيء آخر.
(2) وبعد ذلك تجزئة المعادلة إلى نصفين أحدهما أكسدة والآخر اختزال.
(3) استخراج قيمتي جهدي الاختزال لنصفي التفاعل من السلسلة الكهروكيميائية لحساب (ق. د. ك) عند الظروف القياسية ، وهذه القيمة الأخيرة تمثل الجهد القياسي للخلية الجلفانية التي تؤدي إلى حدوث التفاعل الكيميائي المراد حساب ثابت التوازن له.
حساب الحاصل الأيوني للماء
– يحسب الحاصل الأيوني للماء (Kw) حسب المعادلة التالية:
– وذلك حينما توجد أيونات (+H) و (–OH) بحالة توازن مع جزئيات الماء حسب المعادلة:
– ولحساب ثابت التوازن (Kw) تجرى الخطوات المذكورة سابقاً في المثال التالي.
مثال (3): احسب الحاصل الأيوني للماء (Kw) باستعمال السلسلة الكهروكيميائية ؟
الحل:
حساب حاصل الإذابة لملح شحيح الذوبان
– يحسب حاصل الإذابة لملح شحيح الذوبان (Ksp) من ضرب فعالية أيونات الملح فى المحلول مرفوعة للأسس المناسبة حينما تكون بحالة توازن مع جزيئات غير ذائبة من الملح، أي عند حالة التشبع.
– فحاصل الإذابة لكبريتات الرصاص مثلاً ھو:
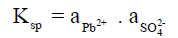
– وذلك لأن حالة التوازن في المحلول تعبر عنھا المعادلة التالية كما يلي:
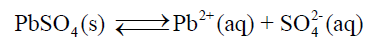
– بينما يكون ھيدروكسيد الكالسيوم مثلاً :
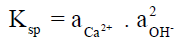
– وذلك لأن حالة التوازن في المحلول تعبر عنھا المعادلة التالية كما يلي:
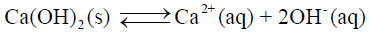
– ولحساب ثابت التوازن (Ksp) تطبق نفس الخطوات المذكورة سابقاً كما في المثال التالي:
مثال (4): احسب حاصل الإذابة لملح كبريتات الرصاص.
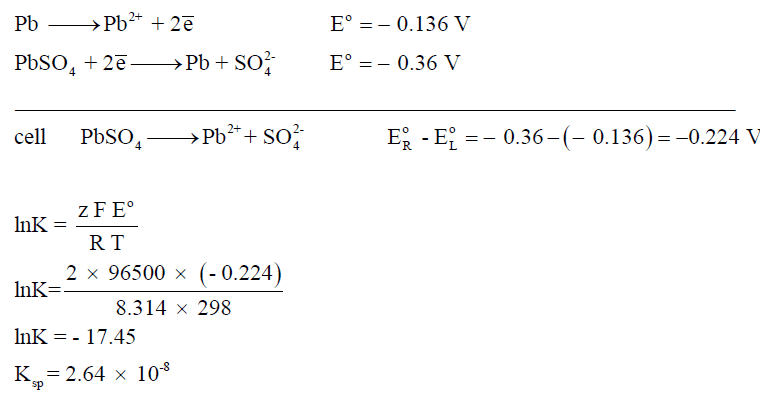
حساب ثوابت تأين الأحماض والقواعد الضعيفة
– لو أخذنا حمض الخل مثالاً للأحماض الضعيفة فإن ثابت تأين الحمض هو كما يلي:
– ولو صممنا خلية جلفانية من قطب الهيدروجين بحيث تكون أيونات الھيدروجين ناتجة عن محلول حمض الخل ، ومن قطب الفضة / كلوريد الفضة المغمور في محلول أيونات الكلوريد فإن تفاعل الخلية سيكون كما يلي:
– ويكون جھد الخلية عند الضغط القياسي كما يلي:
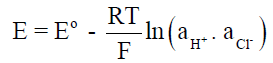
– حيث [+H] ھو تركيز أيونات الھيدروجين الناتجة من تأين حمض الخل ، وبالتالي فإنه بالتعويض عن قيمة (aH) فى المعادلة الأخيرة من قيمتھا المستنتجة من معادلة التوازن لتأين الحمض نحصل على المعادلة التالية والتى منها يمكن حساب قيمة (Ka) كما يلي:
– وفي الواقع فإن الطريقة العملية لذلك تتم من خلال قياس (ق. د. ك) لعدد من الخلايا عند تراكيز مختلفة ثم ترسم علاقة بيانية – بعد تحوير المعادلة الأخيرة – يمكن من خلالها استنتاج قيمة (Ka).
– وتعد هذة الطريقة من الطرق من الطرق الهامة لحساب ثوابت التأين للأحماض والقواعد الضعيفة ولكن نظراً لتشعب العمليات الحسابية المتعلقة بذلك فإنه سيكتفى بما ذكر سابقاً حولها .
المراجع : الفصل الرابع عشر – التطبيقات العملية بإستخدم قياسات القوة الدافعة الكهربية – من كتاب أسس ومبادئ الكيمياء الكهربية الجزء الثاني للمؤلف / عمر بن عبدالله الهزازي أستاذ قسم الكيمياء – كلية العلوم التطبيقية – جامعة أم القرى
 تعرف على علم الكيمياء
تعرف على علم الكيمياء