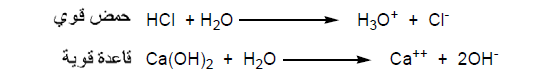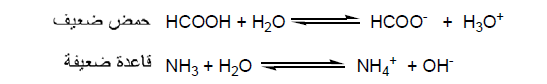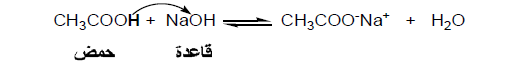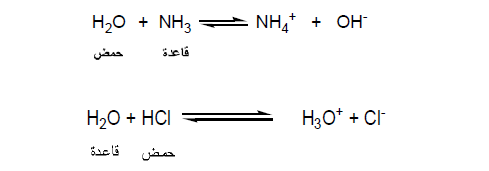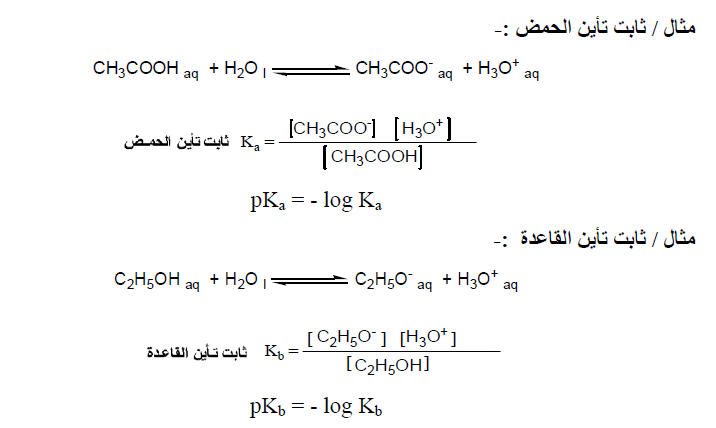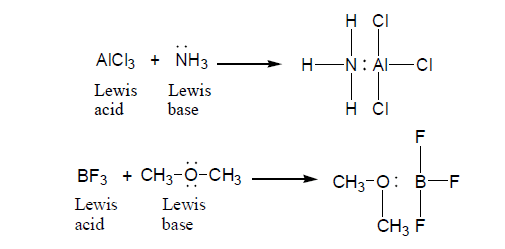الأحماض والقواعد ( نظرية أرهينيوس – نظرية برونستند – نظرية لويس )
في هذا الموضوع سنناقش النظريات الثلاثة التى قامت بتعريف الأحماض والقواعد.
(1) نظرية أرهينيوس Arrhenius theory للأحماض والقواعد
استنتج العالم أرهينيوس سنة 1887 م نظرية تتعلق بالمحاليل الإلكتروليتية والتي تتضمن الأحماض والقواعد ، حيث عرف الحمض والقاعدة كما يلي:
- الحمض هي المادة التي عند ذوبانها في الماء تتأين مكونه أيونات الهيدروجين الموجبة (+H)
- القاعدة هي المادة التي تطلق أيونات الهيدروكسيد السالبة(OH–)
– أن الأحماض والقواعـد القوية تتأين بالكامل في الماء وتكون محاليلها موصلة جيدة للكهرباء وتسمي إليكتروليتات قوية Strong electrolytes.
– المعادلات الأتية توضح تأين حمض الهيدروكلوريك القوي وهيدروكسيد الكالسيوم القوية في الماء كما يلي:
– أن الأحماض والقواعـد الضعيفة تتأين جزئياً في الماء وتكون محاليلها ضعيفة التوصيل للكهرباء وتسمي إليكتروليتات ضعيفة weak electrolytes.
– المعادلات الأتية توضح تأين حمض الخليك الضعيف والنشادر القاعدة الضعيفة في الماء كما يلي:
(2) نظرية برونستند – لوري Bronsted – Lowry theory للأحماض والقواعد
عرفت نظرية برونستند – لوري الأحماض والقواعـد كما يلي:
- الحمض: هو المادة التي تعطي بروتوناً في محلولها.
- القاعدة: هي المادة التي تستقبل ذلك البروتون.
أن لبعض المواد القدرة على فقد واكتساب بروتون في نفس الوقت مثل الماء وتسمي بالمواد الأمفوتيرية amphoteric.
في حالة الأحماض والقواعد العضوية الضعيفة التي تتأين جزئياً في الماء يكون تركيز الأيونات المنطلقة قليل فهي تسلك سلوك التفاعلات العكسية وبالتالي يمكن قياس مدى قوتها عن طريق ثابت تأينها Ka.
عند مقارنة ثوابت التأين لمجموعة من الأحماض المختلفة التي تم قياسها عند نفس الظروف نجد أنه كلما كانت قيمة Ka عالية كلما زادت مقدرة الحمض على التأين ويقترب بذلك من سلوك الأحماض القوية ونفس الشيء للقواعد الضعيفة.
(3) نظرية لويس Lewis theory للأحماض والقواعد
عرفت نظرية لويس الأحماض والقواعـد كما يلي:
- الحمض: هو المادة التي لها المقدرة على كسب زوج من الإلكترونات وتعتبر اليكتروفيلات (electrophile).
- القاعدة: على أنها المادة التي لها المقدرة على منح زوج من الإلكترونات وتعتبر نيوكلوفيلات (nucleophile).
تسمى الرابطة التي تنشأ عن طريق مساهمة أحدى الذرات بزوج من الإلكترونات بالرابطة التساهمية التناسقية Coordinate Covalent bond.
المراجع : الفصل الأول (الترابط وخواص الجزيئات) من كتاب أسس الكيمياء العضوية Foundations of Organic Chemistry” للمؤلفين وائل غالب محمد – وليد محمد السعيطي