السالبية الكهربية Electronegativity
تعريف السالبية الكهربية
السالبية الكهربية هي قدرة الذرة على جذب إلكترونات الرابطة الكيميائية ويرمز لها بالرمز ( X )
الفرق بين الميل الإلكتروني و السالبية الكهربية
– الميل الإلكتروني هو مقدار الطاقة المنطلقة من الذرة المفردة وهي في حالتها الغازية عندما تكتسب إلكتروناً مكونةً أيوناً سالباً.
– إما السالبية الكهربية : هي قدرة الذرة على جذب إلكترونات الرابطة الكيميائية.
– ومن هذه التعريفات يتضح لنا أن الميل الإلكتروني مصطلح طاقة يشير إلى الذرة في حالتها المفردة ، بينما تشير السالبية الكهربيـة إلى الذرة المرتبطة مع غيرها..
السالبية الكهربية وأنواع الترابط بين الذرات
يتم تحديد نوع الروابط الكيميائية بين الذرات حسب الفرق في السالبية الكهربيـة بين الذرات كما هو موضح بالجدول :
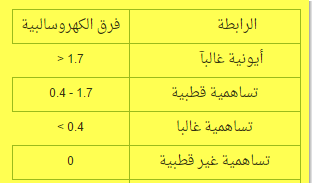
الرابطة التساهمية القطبية
– هي رابطة تنشأ عندما لا يتوزع الزوج الإلكتروني بين الذرتين المرتبطتين بالتساوي.
– فالذرة الأكثر سالبيه كهربيـة تجذب إلكتروني التكافؤ بصورة أكبر وتكون شحنتها سالبة جزيئية ( ᵟ– )
– على العكس الذرة الأقل سالبيه كهربيـة تتكون عليها شحنة موجبة جزيئية ( ᵟ+ ).
الرابطة التساهمية الغير القطبية
هي رابطة تنشأ عندما يتوزع الزوج الإلكتروني للذرتين المرتبطتين بالتساوي.
أمثلة توضيحية
(أ) إذا كان فرق السالبية الكهربية بين العنصرين ( أكبر من 1.7 ) تكون الرابطة أيونية
مثال : NaCl = 3 – 9 = 2.1
(ب) إذا كان فرق السالبية الكهربيـة ( أقل من 1.7 ) تكون الرابطة تساهمية قطبية
مثال: H2O = 3.5 – 2.1 = 1.4
(جـ) إذا كان فرق السالبية = صفر يكون تساهمي نقي
مثال : Cl2 = 3 – 3 = صفر
قياس السالبية الكهربية
يتم قياس السالبية الكهربيـة بطرق عديدة ولكن سوف نتطرق هنا إلى ثلاث مقاييس :
(1) مقياس باولنج Pauling Electronegativity
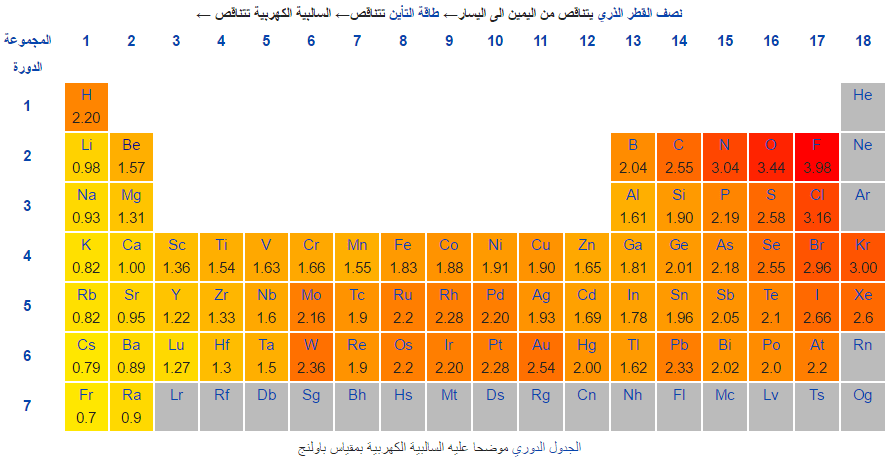
– قام العالم لينوس بولينغ بوضع مقياس رقمي لقيم السالبية الكهربائية حيث لكل عنصر كيميائي سالبية كهربية مميزة تتراوح بين ( صفر – 4 ).
– ويكون عنصر الفلور هو أعلى العناصر في السالبية الكهربيـة حيث تبلغ 3.98 ، بينما أقل العناصر سالبية كهربية هو الفرنسيوم وله قيمة تبلغ 0.7 ، والعناصر الباقية تتراوح قيمها بين هاتين القيمتين.
– ويتم حساب الفرق في السالبية الكهربية بين العنصرين A ، B من العلاقة كما يلي:
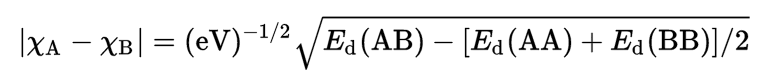
Ed = طاقة التفكك = dissociation energy
xA = السالبية الكهربيـة للعنصر A
xB = السالبية الكهربيـة للعنصر B
(2) مقياس مولكين Mulliken Electronegativity
– يتم حساب الأرقام في مقياس مولكين بعمل متوسط لجهد التأين والألفة الإلكترونية.
– وعلى هذا يتم التعبير عن السالبية الكهربيـة مباشرة بوحدات الطاقة ، وعادة ما تكون بالإلكترون فولت ويعبر عنها بالعلاقة :
Ei = طاقة التأين = ionization energy
Eea = الميل الألكتروني = electron affinity
(3) مقياس Allred-Rochow Electronegativity
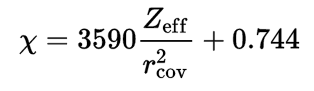
zeff = شحنة النواة الفعالة = effective nuclear charge
rcov = نصف القطر التساهمي = covalent radius
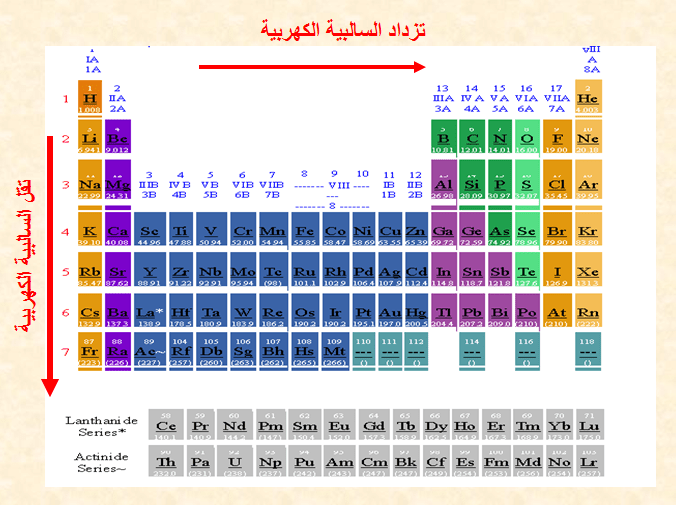
تدرج السالبية الكهربية في الجدول الدوري
في الدورات الأفقية:-
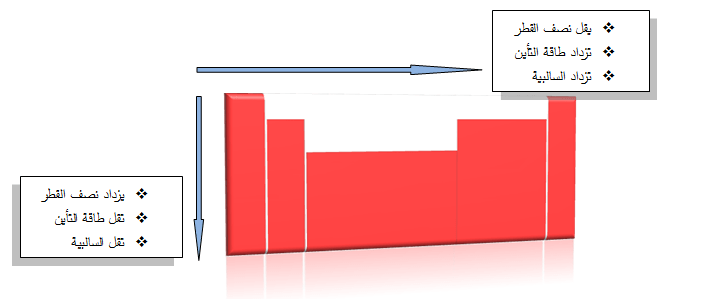
تزداد السالبية الكهربيـة إذا اتجهنا من اليسار إلى اليمين أي بزيادة العدد الذرى ونقص نصف القطر وهذا يؤدى إلى زيادة قوة جذب النواة لإلكترونات الرابطة.
في المجموعات الرأسية:-
تقل السالبية الكهربيـة من أعلى إلى أسفل أى بزيادة العدد الذرى وزيادة نصف القطر وهذا يؤدى إلى نقص قوة جذب النواة لإلكترونات الرابطة.
ملاحظات هامة
(1) الفلور يعتبر أكبر العناصر سالبيه كهربيـة.
(2) الفرق في السالبية الكهربيـة للعناصر له دور فى تحديد نوع الرابطة بين الذرات.
(3) الفلزات لها أقل سالبيه لكبر نصف قطرها.
(4) اللافلزات لها أكبر سالبية لصغر نصف قطرها.
(5) تعتمد السالبية الكهربيـة على الحجم الذري فالذرة الأصغر حجماً تكون الأعلى في السالبية الكهربيـة.
(6) العناصر ذات السالبية الكهربائية الأعلى في الجدول الدوري هي النيتروجين و الأكسجين و الهالوجينات (عناصر المجموعة 17).
(7) العناصر ذات السالبية الكهربائية الأقل في الجدول الدوري هي الفلزات القلوية ( مجموعة 1 ) و الفلزات القلوية الأرضية ( مجموعة 2 ).
(8) الغازات النبيلة بعضها لا يمكن تعيين السالبية الكهربائية له لأنه لا يكون مركبات، وعندما يكون الغاز النبيل مركبات تكون سالبيته الكهربائية عالية جداً و مشابهة لقيمة السالبية الكهربائيـة للهالوجينات.
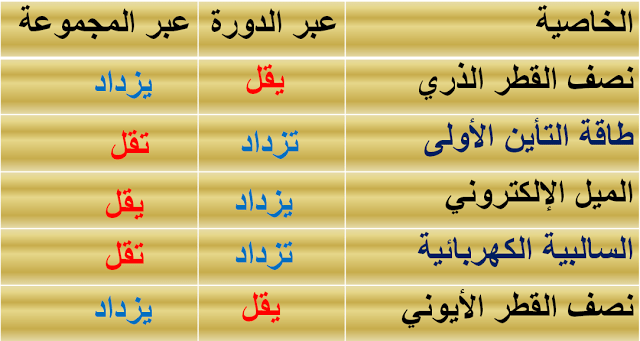
العلاقة بين السالبية الكهربية والخواص الأخرى في الجدول الدوري
الجدول التالي يوضح العلاقة بين السالبية الكهربيـة وبين نصف القطر وطاقة التأين والميل الإلكتروني كما يلي: