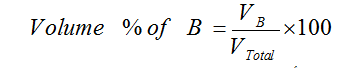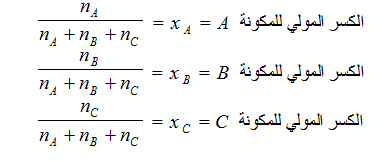طرق التعبير عن تركيز المحاليل Concentration of Solutions
في هذا الموضوع سيتم مناقشة كل الطرق المشهورة المعبرة عن تركيز المحاليل.
المحلول Solution
– المحلول عبارة عن خليط متجانس من مادتين أو أكثر لا يحدث بينهما تفاعل كيميائي.
– وهو عبارة عن نظام ذي طور أو صنف واحد.
– ذوبانية مادة في أخرى لتكوين محلول متجانس يعتمد على طبيعة المواد المتضمنة في عملية الذوبان.
– تتأثر الذوبانية بالتغيرات في درجة الحرارة وبطبيعة المواد المكونة للمحلول والضغط ، بالرغم من أن المؤثر الأخير ذو أهمية بالنسبة للغازات فقط.
– المادة الموجودة بوفرة في المحلول تسمى المذيب (Solvent) بينما الموجودة بنسبة أقل تسمى المذاب (Solute).
– ومع ذلك فإنه بالنسبة لمحلول صلب في سائل يشار دائماً للسائل بأنه المذيب ، علماً بأن هنالك حالات أخرى شاذة يكون فيها الصلب موجودا بكمية أكبر.
تركيز المحاليل Concentrations of Solutions
تركيز المحلول هو النسبة بين كمية المذاب وحجم المحلول.
ويمكن التعبير عن تركيز المحاليل بإحدى الطرق الآتية كما يلي:
(1) طريقة النسبة المئوية % ( V/V -W/W – W/V )
النسبة المئوية الوزنية W/W
– النسبة المئوية الوزنية هي عدد جرامات المذاب في 100 مل من المحلول.
– مثال : محلول مائي تركيزه مثلاً 2% وزناً؛ هذا يعني أن كتلة المذاب 2 جرام في 100 مل من المحلول.
– يمكن تعيين النسبة المئوية بالوزن للمادة المذابة B في وزن معين من المذيب A كما يلي:
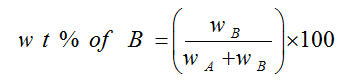
النسبة المئوية الحجمية V/V
– النسبة المئوية الحجمية هي عبارة عن حجم المذاب في 100 مل من المحلول.
– مثال: محلول مائي تركيزه مثلاً 3% حجماً؛ هذا يعني أن حجم المذاب يساوي 3 مل مذابة في 100 مل من المحلول.
– يمكن تعيين النسبة المئوية بالحجم للمادة المذابة B كما يلي:
(2) المولارية Molarity
– المولارية هي عدد مولات المذاب في 1000 مل من المحلول.
– المولارية = عدد مولات المادة المذابة/1000 مل من المحلول
– ويمكن حساب عدد مولات المذاب بالقانون التالي:
عدد المولات = وزن المادة المذابة بالجرام / الوزن الجزيئي للمادة المذابة .
(3) العيارية Normality
– يرمز للعيارية بالرمز N وأحياناً تسمى بالنورمالية.
– العيارية هي عبارة عن عدد الجرامات المكافئة من المادة المذابة في لتر من المحلول.
– ويمكن التعبير عن قوانين العيارية كما يلي:

(4) المولالية Molality
– المولالية هي عبارة عن نسبة عدد مولات المذاب إلى 1000 جرام من المذيب.
– المولالية = عدد مولات المذاب / 1000 جم من المذيب.
– يتم حساب عدد المولات بنفس الطريقة السابقة.

(5) الكسر المولي Mole fraction
– يُرمز للكسر المولي بالرمز x .
– الكسر المولي x لأي مكون في المحلول هو عدد مولات تلك المكونة مقسوماً على عدد المولات الكلية لجميع مكونات المحلول .
– إذا اقترضنا أن nA مول من مذاب A ، وأن nB مول من مذاب B قد أذيبت في nC مول من المذيب C فإن الكسر المولي لكل من هذه المكونات الثلاث يمكن حسابه كما يلي:
يلاحظ أن مجموع الكسور المولية للمكونات يساوي الوحدة:
شاهد بالفيديو جميع قوانين التعبير عن تركيز المحاليل
لمتابعة جميع القوانين والعلاقات الرياضية تابع الفيديو التالي: