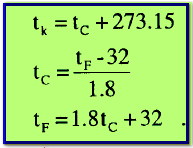فى هذا الموضوع سيتم مناقشة بعض تعريفات الحرارة والمفاهيم الأساسية المتعلقة بالحرارة
محتويات الموضوع
(1) درجة الحرارة Temperature
– درجة الحرارة هى مقياس لتحديد اتجاه الانتقال التلقائي للحـرارة
– ولقد شاعت مفاهيم تعودنا عليها مثل : ساخن، بارد، دافئ، وكلها تعابير تدل على الفرق في درجة الحـرارة.
– وتقاس درجة الحرارة بواسطة مقياس درجة الحرارة (الترمومتر Thermometer) ونعرفه جميعاً بقدر ما شاع استخدامه وشاع كذلك.
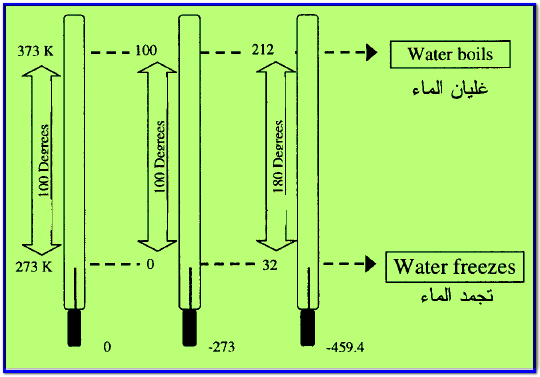
– استخدام ثلاثة تدريجات لقياس الحرارة هي كما يلي:
- التدريج المئوي ويشمل مقياس سيلزيوس Celsius scale
- مقياس كلفن Kelven scale
- تدريج مقياس فهرنهايت Fahrenheit
– ويوضح الشكل التالي المقارنة بين التدريجات الثلاثة كما يلي:
– علاقات التحويل من مقياس لآخر كما يلي:
- Tk= درجة الحـرارة وفق مقياس كلفن (K)
- tC = درجة الحـرارة وفق مقياس سيلزيوس (Co)
- tF = درجة الحـرارة وفق مقياس فهرنهايت (Fo)
إن وحدات النظام الدولي SI تستخدم تدريج كلفن (K)، ويجب أن نتذكر أن درجة الصفر المطلق في تدريج كلفن تعادل (-273.15Co) أى أن:
0 K = -273.15 Co
(2) الحرارة Heat
– إن التغير في درجة الحرارة كمية ما من الماء مثلاً لهو دليل على تغير كمية حرارتها.
– ويمكن قياس كمية الحـرارة التى سببت مثل هذا التغير في درجة الحرارة، باستخدام العلاقة التالية:
Q = m . C . Δt
Q = كمية الحـرارة التى امتصتها (أو فقدتها) كمية من المادة مقدارها m
Δt = التغير في درجة الحـرارة
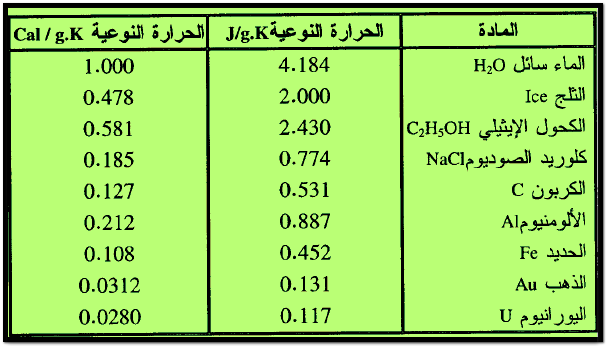
C = الحـرارة النوعية (هي للماء 4.18J/gm.Co)
– الحرارة النوعية وتدعى إيضاً السعة الحرارية النوعية، وهي كمية الحـرارة اللازمة لرفع درجة حترارة واحد من مادة ما درجة مئوية واحدة.
Sp.heat = Cal/gm.Co
Sp.heat = J/gm.Co
– وحدة قياس كمية الحرارة فى وحدات النظام SI يستخدم الجول (Joule) كوحدة لقياس الطاقة الحرارية (أو الحـرارة) وتستخدم كذلك وحدة السعر (Calorie) ورمزها Cal ، K.Cal وعلاقة التحويل هي كما يلي:
1 Cal = 4.184 J
1KJ = 1000 J
1 Cal = 1000 Cal
– تعرف الحـرارة النوعية للماء بأنها كمية الحـرارة اللازمة لرفع درجة حـرارة جرام واحد من الماء من الدرجة 14.5 Co إلى 15.5 Co وهى تساوي سعراً واحداً (1Cal) أو (4.184J)
– يستخدم المسعر لقياس كمية الحـرارة الناجمة عن التفاعل الكيميائي أي القيمة الحرارية لوقود ما كالاحتراق، أو عن التبادل الحراري بين جسمين وأيضاً لتعيين الحـرارة النوعية لمادة.
– إن الحرارة هي شكل من أشكال الطاقة الكهربائية، الكيميائية ، الميكانيكية،…… الخ، وكلها قابلة للتحويل من شكل إلى آخر باستخدام آله مناسبة.
(3) السعة الحرارية Heat Capacity
– السعة الحرارية يرمز لها بالرمز C وهي كمية الحرارة التي يتلقاها الجسم (أو يطلقها) عندما تتغير درجة حرارته بمقدار درجة مئوية واحدة أو التغير في درجة حرارة الجسم عند تلقيه لكمية من الطاقة مقدارها Q
– تحسب السعة الحرارية من القانون التالي كما يلي:
C = Q/Δt cal/Co , J/Co
– أن الجسم ذو السعة الحرارية الكبيرة يمكنه ان يمتص أو يحرر كمية كبيرة نسبياً من الطاقة الحرارية دون أن يرافق ذلك تغير كبير في درجة حرارته.
– ويعد الماء من المواد ذات السعة الحرارية الكبيرة ولذلك فهو يستخدم في نقل الحـرارة في أجهزة التدفئة المركزية وهو الذي يسمح بعدم تغير درجة حـرارة جسم الإنسان كثيراً بسبب التغيرات الخارجية (يحوي جسم الإنسان 60-70% من وزنه ماء تقريباً).
– الحـرارة النوعية هي السعة الحرارية منسوبة إلى جرام واحد من المادة أى أن:
Sp.heat = C/gm
Sp.heat = J/gm.Co
– الجدول التالي يبين قيم الحـرارة النوعية لبعض المواد كما يلي:
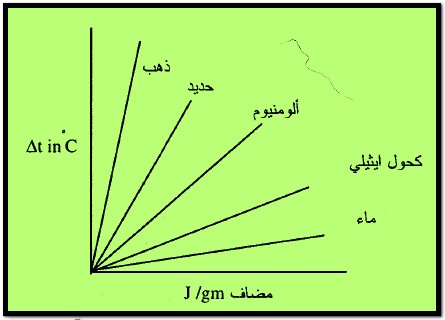
– يوضح الشكل التالي التغير في درجة الحترارة عند إضافة جرام واحد من المواد المبينة كما يلي:
(4) السعة الحرارية المولية Molar heat Capacity
– يرمز لها بالرمز Cm وهي السعة الحرارية لمول واحد من المادة
– أو هي كمية الحرارة (الطاقة) اللازمة لرفع درجة حـرارة واحد مول من المادة درجة مئوية واحدة.
(5) حرارة الانصهار المولية Heat of Fusion
– هي كمية الحرارة اللازمة لانصهار واحد مول من المادة الصلبة وتحولها إلى الطور السائل بدون تغير درجة حرارتها (لاحظ الانصهار يتم عند درجة حـرارة ثابتة).
– فمثلاً إذا سخنا مول واحد من الثلج (18gm) عند درجة حـرارة (-10Co) إلى درجة الصفر المئوي (0C) نجد أن كمية الحـرارة اللازمة لذلك هي كما يلي:
Q = m . C . Δt
– وكانت الحـرارة النوعية للثلج = 2 J/gm Co
Q = 18 x 2 x 10
= 360 Joule
– إذا أضفنا كمية من الحـرارة فإن الثلج يبدأ فى الانصهار عند درجة الحـرارة الثانية (0Co) ونحتاج إلى 6010J لتحويل واحد مول من الثلج عند درجة(0Co) إلى ماء سائل عند نفس الدرجة.
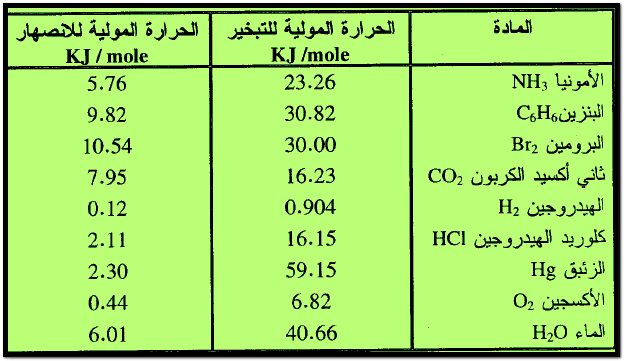
– الجدول التالي يوضح الحـرارة المولية للانصهار والحـرارة المولية للتبخير لبعض المواد كما يلي:
(6) حرارة التبخير المولية Heat of Vaporization
– هي كمية الحرارة اللازمة لتبخير مول واحد من المادة فى الطور السائل إلى الطور الغازي دون تغير درجة حرارتها (أي تتم هذه العملية عند درجة ثابتة من الحـرارة)
(7) حرارة التكثيف المولية Heat of Condensation
– هي كمية الحرارة اللازمة لتكثيف مول واحد من المادة من الحالة الغازية إلى الحالة السائلة وهي عكس حـرارة التبخير.
– وكمثال تنطلق كمية من الحـرارة إلى الوسط المحيط قدرها 40.66 KJ عند تكثيف مول واحد من البخار عند درجة حـرارة 100 Co
(8) حرارة التسامي المولية Heat of Sublimation
– هى كمية الحرارة اللازمة لتحويل مول واحد من المادة فى الطور الصلب إلى الطور الغازي دون المرور بالحالة السائلة وعند درجة حـرارة وضغط ثابتين.
– علاوة على ذلك فأن حـرارة التسامي = حـرارة الانصهار + حـرارة التبخير
(9) حرارة الذوبان Heat of Solution
– وهي مقدار التغير فى المحتوى الحراري الذي يصاحب عملية إذابة مذاب في مذيب.
– كما يعبر عنها بوحدة KJ/mole وتعتمد على التركيز النهائي للمحلول.
– المراجع – مبادئ الكيمياء العامة (نظري – مسائل محلولة). محي الدين البكوش – نوري بسيبسو – ياسر حورية- نبيل شيخ قروش، الطبعة الثانية (2003م) / شركة الجا للنشر العلمي – طرابلس.
 تعرف على علم الكيمياء
تعرف على علم الكيمياء