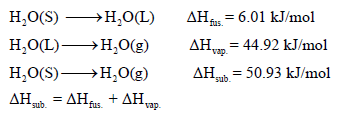التسامي Sublimation
– عملية التسامي هو تحول المادة مباشرة من الحالة الصلبة إلى الحالة الغازية دون المرور بالحالة السائلة.
– كذلك بعض المواد الصلبة قادرة على التبخر تماماً مثل السوائل فتتحول جزیئاتھا إلى حالة غازیة دون المرور بالحالة السائلة وھذه العملیة تسمى بالتسامي Sublimation
– كما یحدث ذلك في ثاني أكسید الكربون الصلب CO2(s) (الثلج الجاف) ، اليود (I2) ، النفثالين (C10H8)
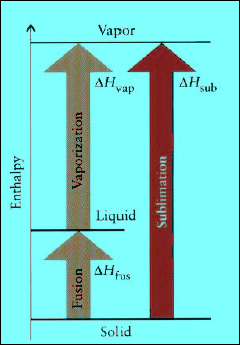
انثالبي التسامي ΔHsub Enthalpy of Sublimation
– أقرب مثال على هذه الأجسام الصلبة والتي لھا ضغوط تسامي مھمة ھي الثلج والثلج الجاف (ثاني أكسید الكربون الصلب).
وبالتالي إذا كنت تعیش في مناطق ذات جو بارد فإنك ستلاحظ اختفاء الثلج من على الأرض بالرغم من أن درجة حرارة الجو یمكن أن تكون أقل من درجة الصفر المئوي، وفي ھذه الحالة لم ینصھر الثلج ولكنه تسامى. وضغط تسامي الثلج عند (0 Co) يساوي 4.55mmHg
كیف ینشأ ضغط بخار المادة الصلبة؟
– تختلف جزیئات المادة الصلبة (التي تتسامى) فیما بینھا بمقدار الطاقة الحركیة.
– وھذا یعني وجود كمیة محددة من الجزیئات وذلك عند درجة حرارة محددة تكون ذات قدر كاف من الطاقة الحركیة یمكنھا من التغلب على قوى التجاذب فیما بینھا وبین الجزیئات الأخرى، ویتیح لھا بالتالي فرصة الانفلات من حالة التماسك الصلبة إلى الحالة الغازیة.
– وستصل سرعتا تحول جسیمات المادة الصلبة من الحالة الصلبة إلى الحالة الغازیة والعكس عند ثبوت درجة الحرارة إلى حالة التساوي (في الأنظمة المغلقة)، وھذا یدل على نشوء حالة توازن دینامیكي بین الحالتین الصلبة والغازیة.
– وعند حدوث التوازن عند درجة معینة فإن ضغط بخار المادة الصلبة یكون ثابتاً ویسمى ضغط بخار المادة الصلبة Equilibrium Vapour Pressure of Solid
مثال توضيحي
عند وضع الثلج الجاف في وعاء مغلق فإنه یتبخر تدریجیاً وفي نفس الوقت فإن بعض الجزیئات المتبخرة أیضاً تعود للتجمد.
وعندما تكون سرعة تحول الجزیئات الصلبة إلى الحالة الغازیة تساوي سرعة تحول الجزیئات الغازیة إلى الحالة الصلبة، نكون قد وصلنا إلى حالة اتزان، وفي ھذه الحالة یثبت ضغط البخار وھو ما یسمى بضغط بخار المادة الصلبة.
العوامل المؤثرة على قيمة ضغط بخار مادة صلبة
(1) طبیعة المادة:
(2) درجة الحرارة:
بعض التطبيقات العملية للتسامي
(1) من التطبیقات العملیة للتسامي، التجفیف بالتجمید Freeze Drying
فالقهوة الجاھزة المجففة بالتجمید، مثلاً، یتم صنعھا عن طریق تجمید كمیة من القھوة المغلیة وبعد ذلك یتم نزع الجلید بواسطة التفریغ الھوائي (علل)
وذلك لأن التفریغ الھوائي یؤدي إلى إيجاد جو من الضغط المنخفض یتسامى فیه الجلید بسرعة.
وتحافظ عملیة نزع الماء بھذه الطریقة على الجزیئات الحساسة والدقیقة، التي تعطي للقھوة نكھتھا، وھكذا یتم تحسین جودة الإنتاج.
(2) یتم تجفیف أطعمة صلبة – وحتى وجبات كاملة – بالتجمید. وذلك للحفاظ على طعمھا، بالإضافة إلى منعھا من التلف.
حیث أن البكتیریا التي یمكن أن تسبب أذى لا تستطیع أن تنمو وتتكاثر بمعزل عن الرطوبة، وھذا ما یسمح بتخزین الأطعمة المجففة بالتجمید بدون تبرید، ویمكن إعادة تكوینھا بمجرد إضافة الماء إلیھا. وغالباً ما یتزود ھواة المخیمات بھذه المنتجات بسبب طبیعتھا العملیة.
المراجع: أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية.
 تعرف على علم الكيمياء
تعرف على علم الكيمياء