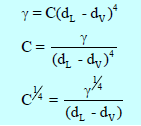فى هذا الموضوع سوف نستعرض ما هو المقصود بمصطلح الباراكور وأهم تطبيقاته علاوة على ذلك مسائل محلولة توضيحية.

الباراكور Parachor
– یعتبر التوتر السطحي المؤدي للقوة المؤثرة للداخل على الجزیئات عند سطح السائل متوقف على
طبیعة ومكونات المادة للسائل.
– في عام 1923 وضع ماكلويد Macleod علاقة تجريبية بين التوتر السطحي وبين الكثافة للسائل (dL) وبخاره (dV) كما يلي:
dL : كثافة السائل
dV : كثافة البخار
C: ثابت للسائل خاص به
– في عام (1924) أدخل سودجن (Sudgen)عدة تعديلات على هذه العلاقة وذلك بإدخال الوزن الجزيئي (Mw) للسائل ، وعرف الثابت الجديد بالباراكور (P) (Parachor) والمعادلة التقريبية هي:
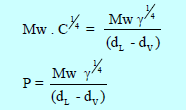
وعندما نهمل (dV) كثافة البخار مقارنة بكثافة السائل (dL) فأن العلاقة تختصر إلى:
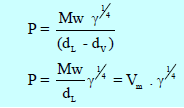
Mw/dL يساوي الحجم الجزيئي (Vm)
وعندما يساوى التوتر السطحي الوحدة (γ = 1 ) فإن Vm = P
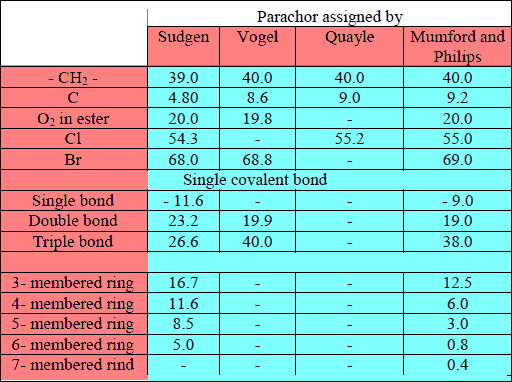
– الجدول التالي يوضح قيم Parachor لبعض المواد المختلفة التراكيب:
أمثلة محلولة
التوتر السطحي لمركب (C7H7Cl) P-chlorotoluene هو 32.24 dynes/cm وكثافته عند هذه الدرجة (1.065 g/cm3) فما هي قيمة الباراكور المولار؟ وماهي القيمة المحسوبة من الباراكور الذري والتركيبي؟
علماً بأن الكتل الذریة: ( C = 12, H = 1, Cl = 35.5)
الحل:
من المعادلة:
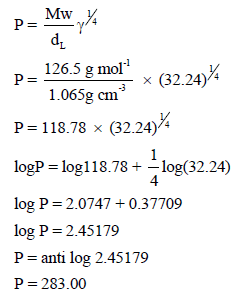
حساب قیمة Parachor الذري والتركیبي للمركب:
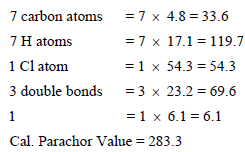
وھذه القیمة ھي نفس القیمة السابقة تقریباً.
تطبيقات الباراكور Application of Parachor
(1) لا یغیر وضع المجموعات الاستبدالیة في الحلقة قیمة الباراكور للمركب.
فكما ھو مبین في المثال السابق حیث P.Cl.toluene هى 283.2 وهى نفس القيمة لو كان المركب هو O.Cl.toluene
(2) في بعض الأحیان : الباراكور یمكن استخدامه للتفرقة بین الأشكال المختلفة للمركب.
مثال: ھذا الشكل التتابعي یمكن تحقیقه بالنسبة للكیونین Quinine

والقیمة المستنتجة تجریبیاً ھي القیمة 236.8 مما یدل على أن المركب الموجود على الشكل (I)
(3) اقترح Sudgen تركیبات مختلفة لمجموعة النیترو
وقد حسب الباراكور كما ھو متبع في الشكل التالي:
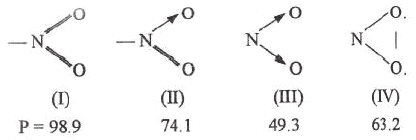
والقيمة الملاحظ [P] لهذة المجموعة هي 71.4 مما يدل على أن المركب (II) هو الأكثر استقراراً والموجود.
المراجع: أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء كلية العلوم – جامعة أم القرى – المملكة العربية السعودية.
 تعرف على علم الكيمياء
تعرف على علم الكيمياء