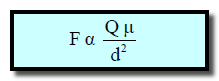توجد قوى التجاذب بين جزئيات السائل وتكون أضعف بكثير من الرابطة التساھمیة التي تربط بین الذرات في الجزيء، فمثلاً الطاقة اللازمة لتبخیر السائل ( إبعاد الجزیئات بعضھا عن بعض) أقل بكثیر من الطاقة اللازمة لتكسیر الروابط في جزیئات السائل.
أنواع قوى التجاذب بين الجزيئات Types of Intermolecular Attractive Forces
(1) قوى ثنائي القطب – ثنائي القطب Dipole-Dipole Attractive Forces
(2) قوى التجاذب بين أيون وجزيء ثنائي القطب Ion-Dipole Attractive Forces
(3) قوى التجاذب بين أيون وجزيء قطبي مستحث Ion-Induced Dipole Attractive Forces
(4) الرابطة الهيدروجينية Hydrogen Bond
(5) قوى لندن التشتتية London Dispersion Forces ( قوى فان درفالز)
وسوف نشرح كلأ منهما بالتفصيل:
أولاً/ قوى التجاذب بين ثنائيات الأقطاب Dipole-Dipole Attractive Forces
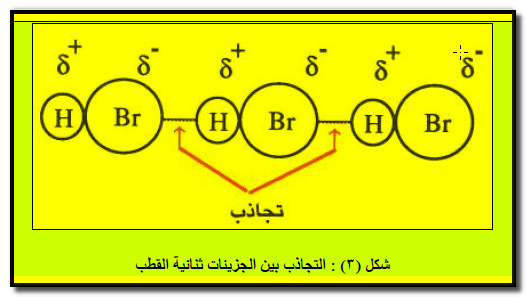
- وھي قوى تجاذب تنشأ بین الجزیئات القطبیة مثل: كلورید الھیدروجین (HCl) ، برومید الھیدروجین (HBr) ، كلورید الیود (ICl) ، الكلوروفورم (CH3Cl) ، ثنائي كلورید المیثان CH2Cl2.
- تنظم ھذه الجزیئات نفسھا، بحیث یقترب القطب الموجب لجزيء من القطب السالب في جزيء آخر كما یظھر من الشكل (٣) .
- تتخذ النھایات المختلفة للأقطاب أوضاعاً متقابلة مما یؤدي إلى تجاذبھا. ومن أھم العوامل المؤثرة على قوى التجاذب بین ثنائیات الأقطاب: طریقة توجیه هذه الأقطاب .
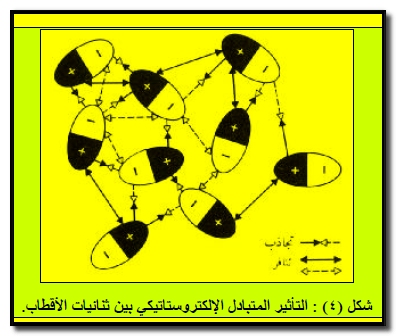
- تمیل الجزیئات ثنائیة القطب إلى أن ترتب نفسھا. بحیث أن الشحنة الموجبة الجزئیة على أحدھا تكون بقرب الشحنة السالبة الجزئية على الجزیئات الأخرى. وبما أن الجزیئات في حركة وتصادم مستمرین مع بعضھا بعضاً، فأن ھذا الوصف یكون بعیداً عن الكمال، خاصة في السوائل والغازات، ومع ذلك، یرجح التجاذب بین الأطراف المشحونة بشحنات متعاكسة للجزیئات ثنائیة القطب على التنافر بين الأطراف المتماثلة الشحنة، فیتواجد نتیجة ذلك تجاذب إجمالي صافي بینھا ( شكل ٤) .
س : قارن بين التجاذبات ثنائية القطب والروابط الأيونية أو الروابط التساهمية ؟
التجاذبات بین الجزیئات ثنائیة القطب أضعف بكثير عادةً من الروابط الأيونية أو التساهمية ، فهي حوالي (%1) فقط من قوتها. وشدتها تتناقص بسرعة كبيرة كلما ازدادت المسافة بین ثنائیات الأقطاب. وھكذا فإن تأثیراتھا بین جزئيات الغاز الشديدة التباعد أقل بكثير مما هي علية بين الجزئيات المرصوصة بإحكام في السوائل أو المواد الصلبة. وهذا هو سبب تصرف جزئيات الغاز وكأنما ليس بينها قوى تجاذب على الإطلاق.
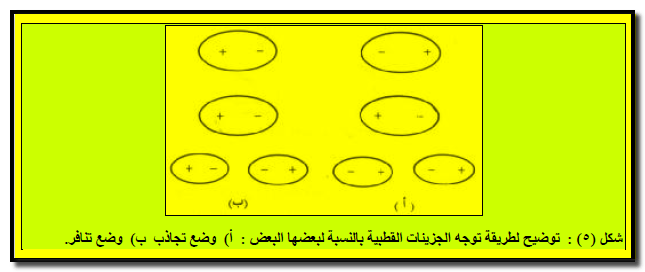
وبالمقارنة بین الحالتین الصلبة والسائلة من جھة أوضاع الجزیئات ثنائیة القطب فإنه:
في الحالة الصلبة : یتم ذلك بحیث تكون قوى التجاذب كبیرة جدا (شكل ٥ أ). أما في الحالة السائلة وبسبب قدرة الجزئيات على الحركة المستمرة فإن الذي يحدث هو اتخاذ الأقطاب مرات لأوضاع متجاذبة ومرات أخري لأوضاع متنافرة (شكل ٥ ب) . ولكن وجد أن الحاصل النھائي ھو حدوث تجاذب فیما بین الأقطاب بمعدل أعلى من التنافر . ولقد وجد أن ذلك یتناسب طردیاً مع مربع العزم القطبي لكل قطب (μ2 ) وعكسیاً مع القوة السادسة للمسافة الفاصلة بین مركزي القطبین (d6) :
س: ما تأثیر ازدیاد المسافة على هذه القوى؟
ج- من العلاقة :
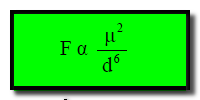
فأن تأثير هذه القوي يتلاشى تدريجياً بازدياد المسافة ولا يكون أثره هاماً إلا في الحالات التى تكون فيها الجزئيات متقاربة من بعضها البعض .
ثانياً/ قوى التجاذب بين أيون وجزيء ثنائي القطب Ion-Dipole Attractive Forces
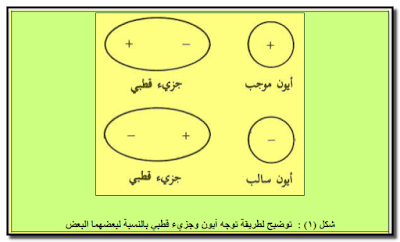
س: كیف یتوجه أیون وجزيء قطبي لبعضھما البعض؟
ج : عند وجود أیون – سالباً كان أو موجباً – بالقرب من جزيء قطبي فإن كلاً منھما سیتوجه بطریقة معینة تؤدي إلى تجاذبھما ، حيث یواجه الأيون وضعاً معیناً بحیث یواجه نھایة القطب المخالفة له بالإشارة ( شكل ١ ) .
ولقد وجد أن قوة التجاذب الناشئة في هذه الحالة (F) تتناسب طردیاً مع كل من شحنة الأیون(Q) والعزم القطبي للجزيء (μ) وعكسیاً مع مربع المسافة الفاصلة بین مركزي الأیون والجزيء ( d2 )
مثال توضيحي لأثر القوى القطبية :
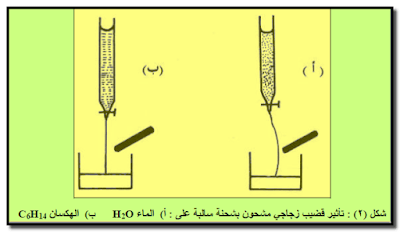
عند حك قضیب زجاجي بقطعة من الحریر ( یكتسب شحنة سالبة) ومن ثم تقریبه من تیار مائي منساب عبر سحاحة فإن تیار الماء سینحرف باتجاه القضیب ( شكل ٢ أ) هذا الانحراف نحو القضيب لا يحدث فيما لو أستخدم سائل الهكسان C6H14 عوضاً عن الماء ( شكل ٢ ب )
س: علل ما یحدث في الحالتین ؟
ج : بسبب اتخاذ جزئيات الماء H2O ( القطبية ) وضعاً تكون فيها النهايات الموجبة للأقطاب باتجاه قضیب الزجاج ذي الشحنة السالبة الأمر الذي لا يحدث في حالة الھكسان لكون جزیئاته غیر قطبیة .
ثالثاً/ قوى التجاذب بين أيون وجزيء قطبي مستحث Ion-Induced Dipole Attractive Forces
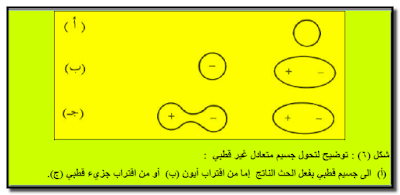
يؤدي اقتراب أيون ما أو جزئ قطبي من جزئ أو ذرة متعادلة (أو غير قطبیة) إلى التأثیر على السحابة الإلكترونیة للجسیم غیر القطبي بحیث تكون كثافتھا حول الجسيم متفاوتة فتكون عالية فى ناحية ومنخفضة فى الناحية المعاكسة كما یتضح من الشكل (6) وفي كلا الحالتین فإن الجسم المتعادل وغير القطبي يكتسب الصفة القطبية عن طريق الحث مما يؤدي إلى نشوء تجاذب بين القطب المستحث والأیون (أو الجزيء القطبي) الذي قام بعملیة الحث .
س: ما العوامل المؤثرة على قوة التجاذب فیما بین القطب المستحث والأیون ( أو الجزيء القطبي) الذي قام بعملیة الحث؟
(١) مقدار ھذه القوة یتناسب طردیاً مع مدى السهولة التى يمكن بها حدوث عملية الحث. والتي تعتمد بدورها على المدى المتاح للسحابة الالكترونية للجسيم المتعادل غير الأيوني ليمتد تأثيرها وفعلها عليه وهو ما يسمى بقابلية الإستقطاب (Polarizability). والتي تكون عالية فى حالة الجسيمات ذات العدد الأعلى من الإلكترونات أولا والمتمیزة بسعة انتشار سحابتھا الإلكترونیة ثانیاً .
(٢) كذلك تتناسب عكسیاً مع القوة الرابعة للمسافة الفاصلة بین مركزي الجسمین (d4)
س: متى تكون قابلیة الإستقطاب عالیة (Polarizability) ؟
- في حالة الجسیمات ذات العدد الأعلى من الإلكترونات.
- في حالة الجسیمات المتمیزة بسعة انتشار سحابتھا الإلكترونیة.
رابعاً/ قوى التجاذب بسبب الرابطة الهيدروجينية Hydrogen Bond
- تنشأ الرابطة الھیدروجینیة بین الجزیئات ثنائیة القطب بشكل خاص عندما ترتبط ذرة الھیدروجین تساھمیاً مع عنصر صغیر جداً ذي سالبیة كھربیة عالیة مثل :الفلور، الأكسجین، النیتروجین . ففي ھذه الحالات التي تنتج جزیئات عالیة القطبیة للغایة. حیث تحمل ذرة الھیدروجین الصغیرة كمیة لا بأس بھا من الشحنة الموجبة. وبما أن النھایة الموجبة لثنائي القطب بإمكانھا الاقتراب عن كثب من النھایة السالبة لثنائي قطب مجاورة. فقوة التجاذب بین النھایتین كبیرة إلى حد ما. ویدعى ھذا النوع الخاص من التجاذب ثنائي القطب بالرابطة الھیدروجینیة (Hydrogen Bond) وتعادل حوالي % 5 إلى % 10 من قوة الرابطة التساھمیة العادیة .
- الرابطة الھیدروجینیة ھي إحدى أنواع القوى القطبیة (رابطة فیزیائیة) بل أكثر قوة منها. ومما سبق فإنها تنشا نتيجة فرق كبير في السالبية الكهربية بين ذرة الهيدروجين ( ذي السالبية الكهربية 2.2) في جزئ (المرتبطة أصلاً بذرة أكسجين أو نتيروجين أو فلور) وذرة عنصر آخر مثيل لها سالبية كهربية عالية مثل: (N = 3, O = 3.5, F =4).
- ویتم تكوین ھذه الرابطة من خلال زوج الإلكترون الحر الموجود علي الأكسجين أو الفلور أو النيتروجين التي تنتمي للجزئ الآخر المثيل. وبسبب أن الفرق في السالبیة كبیر فتتكون رابطة قویة.
- ولا یحدث الترابط الھیدروجیني إلا في وجود ذرات الهيدروجين فقط (علل). وذلك لأن للذرات الأخرى أغلفة الیكترونیة تحجب أنویتھا عن ذلك الترابط . لهذا نجد أن الرباط الهيدروجيني لا يحدث إلا مع المركبات التي تحتوي على الهيدروجين دون غيرها .
س : ما تأثیر الفرق في السالبیة الكھربیة بین الھیدروجین والذرات (F, N, O) ؟
ج : هذا الفرق كاف لإحداث استقطاب في الجزئ ( بمعنى نشوء نهايتين أحدهما موجبة والأخرى سالبة ).
س: كیف یحدث ھذا الاستقطاب؟
ج : يحدث استقطاب الجزئ نتيجة لانحياز الإلكترونات الرابطة بين الذرتين نحو الذرة الأعلى سالبية كهربية مما يجعل السحابة الإلكترونية حولها ذات كثافة أعلى منها حول ذرة الهيدروجين فيصبح الجزئ عبارة عن قطب يكون الهيدروجين نهايته الموجبة .
س: ماذا ینتج عن نشوء الجزیئات القطبیة السابقة ؟
ج: ینشأ قوى تجاذب بین ھذه الجزئيات القطبية من نوع قوي التجاذب بين جزئ ثنائي القطب وآخر ثنائي القطب. حیث تتجاذب الجزیئات عبر نھایاتھا القطبیة :
ونظراً لأن ذرة الھیدروجین ھي المشارك في جعل الجزيء قطبیاً، لذلك تسمى القوة الرابطة بين الجزئيات ثنائية القطب بأسم الرابطة الهيدروجينية (مثلث الرابطة الھیدروجینیة بالخط المنقط ).
إن وجود الرابطة الهيدروجينية بين الجزئيات يؤدي إلى زيادة تجاذبها مع بعضها البعض وبالتالي یزید من درجة غلیانھا ویقلل من ضغطھا البخاري.
وكلما زاد عدد الروابط الهيدروجينية بين الجزئيات فإن ذلك يؤدي إلى زيادة تجاذبھا مع بعضھا البعض وبالتالي یزید من درجة غلیانھا .
علل : درجة غلیان الماء (H2O (100 °C أعلى من النشادر (NH3 (-33 °C ؟
ج: ذلك أن عدد الروابط الھیدروجینیة في الماء أعلى منھا في النشادر .
علل : درجة غلیان فلورید الھیدروجین (HF (17 °C أعلى من درجة غليان بروميد الهيدروجين (HBr ( – 70 °C؟
علل : درجة غليان الماء (H2O (100°C أعلى من درجة غليان كبريتيد الهيدروجين (H2S (- 61 °C ؟
ج : لوجود روابط هيدروجينية بين جزئيات الماء (H2O)بينما لا توجد هذه الروابط الهيدروجينية بين جزئيات كبريتيد الهيدروجين (H2S).
علل: لا توجد روابط هيدروجينية بين جزئيات الإيثر الميثيلي (H3C-O- CH3) ؟
ج: وذلك لعدم وجود ذرة ھیدروجین مرتبطة بذرة ذات سالبیة كھربیة مرتفعة مثل .(F, N, O)
س: هل يمكن للرابطة الهيدروجينية أن تتكون إذا استبدلنا (N, O, F) بذرة كبريت (S) أو كلور(Cl) أو بروم (Br) ؟ لماذا ؟
ج: لا تنشأ الرابطة الھیدروجینیة إذا استبدلنا ذرة الأكسجین أو النیتروجین أو الفلور بأي ذرة أخرى كذرة الكبریت (S) أو البروم (Br) أو الكلور (Cl) على الرغم من أن كهروسالبیتھا عالیة كالسابقات، وذلك لأن ذرة الهيدروجين صغيرة جداً ویناسب صغرھا ھذا صغر ذرات الأكسجین والنیتروجین والفلور .
أهمية الرابطة الهيدروجينية
- الرابطة الھیدروجینیة هي أحد أنواع قوي التجاذب الضعيفة ذات الأهمية الكبيرة. ففي الماء مثلاً تؤثر الجزیئات بقوة على بعضھا البعض بواسطة الرباط الھیدروجیني (شكل ٧). وینتج عن ھذا قوى تجاذب أقوى بكثیر من تلك التي بین جزیئات أخرى مماثلة لھا في الحجم والكتلة. وھي التي تجعل الماء سائلاً عند درجة حرارة الغرفة.
- الرباط الهيدروجيني مسئول أيضاً فى التحكم فى توجيه جزئيات الماء فى حالة الجليد حيث يوجد كل جزئ من جزئيات الماء محاطاً بأربعة جزئيات أخري ومرتبطاً معها بواسطة روابط هيدروجينية. وسبب هذا في امتلاك الجلید لبنیة “مفتوحة ” للغایة، وفي جعل الجلید أقل كثافة من الماء السائل حیث یطفو فوقه. ولھذا السبب تطفو المكعبات والجبال الجلیدیة (وھذا ھو السبب في الكارثة التي حلت بسفینة الركاب تیتانك Titanic التي غرقت إثر اصطدامھا بجبل جلیدي).
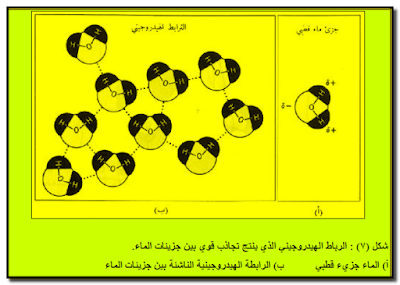
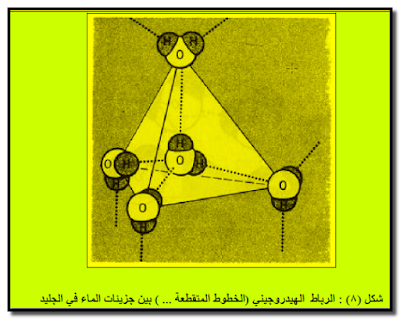
تأثير الرابطة الهيدروجينية على صفات الماء
- ینتج عن الرابطة الھیدروجینیة في الماء قوى تجاذب أقوى بكثير من تلك التى بین جزیئات أخرى مماثلة لھا في الحجم والكتلة.
- بسبب الروابط الهيدروجينية نجد أن الماء له درجة غليان عالية حيث تبلغ الحرارة النوعية المكتسبة للتبخير (2257J/g).
- الروابط الھیدروجینیة بین جزیئات الماء ھي التي تجعل الماء سائلاً عند درجة حرارة الغرفة .
- تفسر قوة هذه الرابطة صغر المسافة التى تربط بين ذرات الهيدروجين والأكسجین مما ینتج عنه انخفاض ملحوظ في كثافة الماء عند درجة التجمد .
- الترابط الهيدروجيني مسئول أيضا عن التحكم في توجيه جزئيات الماء في الجليد كما سبقت الإشارة إليه.
أمثلة للرابطة الهيدروجينية
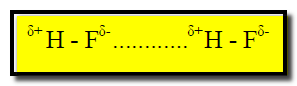
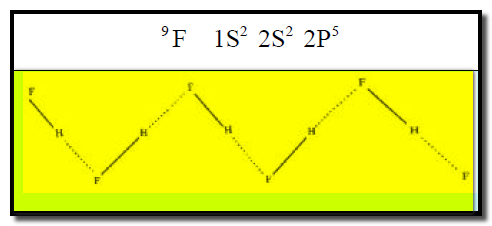
(1) جزيء فلورید الھیدروجین HF
علل : تظھر جزیئات فلورید الھیدروجین HF على هيئة خطوط متعرجة؟
ج: يوجد على ذرة الفلور المرتبطة بالهيدروجين ثلاثة أزواج الكترونية حرة وبالتالي فإنه يمكن لذرة الفلور عمل رابطة هيدروجينية مع ذرة هيدروجين جزئ آخر من (HF) في أي اتجاه. لھذا السبب تظھر جزیئات (HF)على هيئة خطوط متعرجة .(zigzag). (2) جزيء الماء H2O
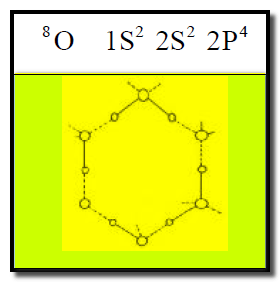
(2) جزيء الماء H2O
علل : ظھور جزیئات الماء على ھیئة شبكة؟
ج: نظراً لوجود زوجین الكترونیین حرین في ذرة الأكسجین المرتبطة بالھیدروجین فإنه یمكن لذرة الأكسجین عمل رابطة هيدروجينية مع ذرة هيدروجين جزئ آخر(H2O) فى أي اتجاه من هذين الاتجاهين. لهذا السبب تظهر جزئيات الماء على هيئة شبكة .
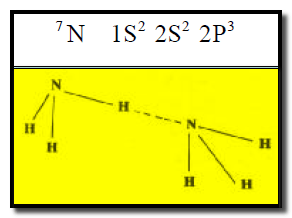
(3) جزيء النشادر NH3
علل : تظھر جزیئات النشادر على ھیئة تفرعات ؟
ج: نظراً لوجود زوج الكتروني حر في ذرة النیتروجین المرتبطة بالھیدروجین فإنه لا یمكن لذرة النیتروجین عمل رابطة ھیدروجینیة مع ذرة ھیدروجین جزيء آخر إلا في اتجاه واحد، لھذا السبب تظھر جزیئات النشادر على ھیئة تفرعات .
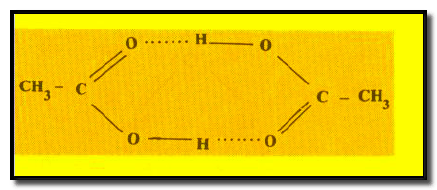
(4) بعض المركبات العضویة Some Organic Compounds
أ- حمض الخل CH3COOH
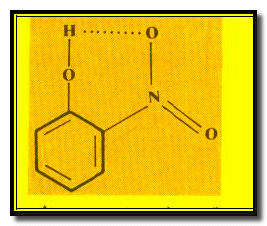
ب- أورثونیتروفینول O-Nitrophenol
وفیه تظھر الرابطة الھیدروجینیة في نفس الجزيء.
خامساً/ قوى فان درفالز Van der Waals Forces
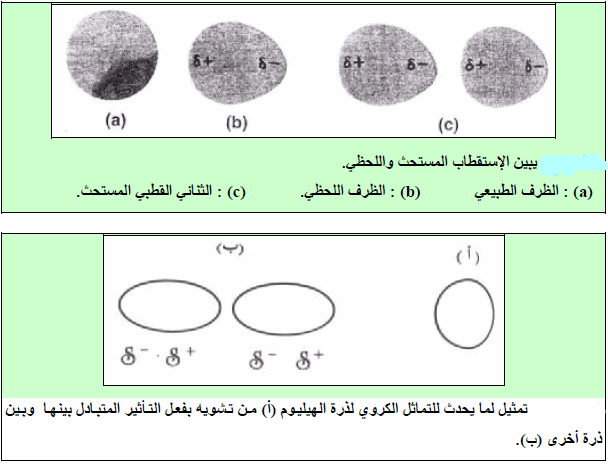
- نظراً لعدم قدرة الھیلیوم (He) لتكوین روابط كیمیائیة مستقرة، لھذا یتوقع أن یبقى ھذا العنصر على ھیئة غاز حتى درجة الحرارة (0 Ko = -273 Co) وبالرغم من تواجده على ھیئة غاز حتى عند درجات حرارة منخفضة إلا أنه یتكثف الى سائل عند (4 Ko) ویتجمد متحولاً الى صلب عند ضغط (25 atm) وعند درجة حرارة .(1 Ko)
- توحي ھذه المعلومات بوجود قوى بین ذرات الھیلیوم – ھذه القوى ضعیفة ولكنھا موجودة بدون شك. وعند انخفاض درجات الحرارة بصورة كافیة فإن ھذه القوى تتغلب على الإثارة الحراریة مما یؤدي الى تكثف الھیلیوم. وتعرف ھذه القوى المسببة لذلك بقوى فان درفالز. وھذه القوى ھي القوى الموصوفة عند تطبیق معادلة فان درفالز في حالة الغازات الغیر مثالیة .
س) علل : تسمیة الروابط بین الجزیئات بالروابط الفیزیائیة؟
ج) بسبب أن قوى التجاذب المذكورة لا تؤدي إلا إلى إحداث تغیرات فیزیائیة على المادة. بمعنى أن تلك الروابط لا تؤدي الى حدوث تغیر في الطبیعة الكیمیائیة للمادة.
مثال توضيحي:
الفرق بین الروابط الكیمیائیة وبین الروابط الفیزیائیة

قوى لندن التشتتية London Dispersion Forces
- ولقد وجد عملیاً أن الغازات النادرة مثل الھیلیوم (He) (ذرات غير متحدة) والجزئيات غير القطبية (المتعادلة كهربياً) مثل(O2 , N2 , C2H4 , CCl4 , C6H6) يمكن تحویلھا الى الحالة السائلة إذا خفضت درجة حرارتھا، وھذا یدل على وجود قوى تجاذب بینھا وسمیت بقوى لندن (London Forces) نسبة إلى الفیزیائي الألماني (Fritz London) الذي قام بتفسیرھا عام (1928) وتسمى أیضاً بقوى (Dispersion Forces)
- توجد قوى لندن التشتتية في السوائل والجوامد أیضاً.
نشوء قوى لندن بين الجزيئات
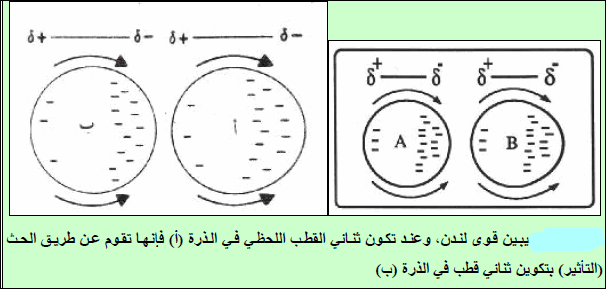
- عندما تتحرك الإلكترونات حول الذرة أو الجزيء فإنھا تتحرك بشكل عشوائي. وفي لحظة ما ھناك احتمال وجود عدد أكبر من الإلكترونات في أحد طرفي الذرة أكثر مما في الطرف الآخر. مما یؤدي الى تكون وضع یشبه الجزیئات القطبیة (یكون الجسیم ثنائي القطبیة)
- ھذه القطبیة مؤقتة ونسمیه ثنائي قطب لحظي (instantaneous dipole) لأن وجوده فقط لفترة زمنیة قصیرة. وھذه تؤثر على الذرات أو الجزیئات المجاورة فتنشأ جزیئات مستقطبة (حركة الإلكترونات في الجسیمات المتجاورة في مجموعة من الذرات أو الجزیئات لیست مستقلة تماماً عن بعضھا بعضاً فأثناء بدء تكوین النھایة السالبة (لثنائي قطب لحظي) في إحداھا، تقوم بدفع الإلكترونات بعیداً في الجسیم المجاور كما في الشكل التالي ونقول بأن (ثنائي القطب اللحظي) یحرض على تكوین (ثنائي قطب) في جاره.
- نتیجة لذلك ینشأ تجاذب بین الجزیئات المستقطبة في لحظة وجودھا،. وھذه القوى تكون عادة ضعیفة نسبیاً بسبب وجودھا السریع الزوال.
قوى لندن موجودة بین كافة الجسیمات أي في الأیونات والجزیئات القطبیة واللاقطبیة.
ولكنھا تلعب دوراً ثانویاً (غیر أساسي) جداً في التجاذبات بین الأیونات (علل)، وذلك لأن قوى التجاذب بین الأیونات قویة للغایة. وقوى لندن تلعب دوراً لا بأس به في التجاذبات القائمة بین جمیع أنواع الجزیئات، وبشكل خاصبین الجزیئات اللاقطبیة .
- تعرف ثنائي القطبیة سھلة الإستحداث في الذرة بالإستقطابیة. وتبعاً لزیادة استقطابیة الجزيء تزید قوى لندن (قوى الإنتشار (التشتت). وھذه الإستقطابیة تزید بزیادة عدد الإلكترونات والتي تزید كلما زاد الرقم الذري وبالتالي زیادة كتلة الجزيء.
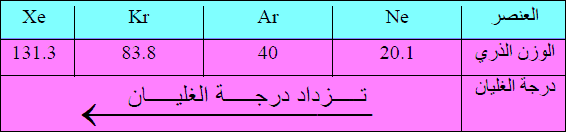
- تتباعد بعض الإلكترونات عن مركز أو نواة الذرة في الجزیئات الكبیرة، وبالتالي یقل تماسكھا مما یسھل من عملیة استبدالھا وبالتالي تزید استقطابیة الجزيء . فالجزیئات الثقیلة أكبر تجاذباً من الجزیئات الخفیفة، وبالتالي أقل في الضغط البخاري وأعلى في درجات الغلیان. فللھیلیوم مثلاً ذو الرقم الذري (2) والكتلة الذرية (4) درجة غليانة (4 Ko) بینما نجد أن للرادون ذو الرقم الذري (86) والكتلة الذرية (222) درجة غليانة (211 Ko)
- في جزيء الھیدروجین (H2) أو الفلور (F2) فإن الفرق في السالبية الكهربية صفر، وبما أن الإلكترونات جسیمات غیر ثابتة فمن المحتمل أن تتركز في منطقة دون أخرى في أي من الأوقات (أي مؤقتاً)، وفي ھ ذه الأثناء تكون ھذه المنطقة سالبة وما یقابلھا موجبة فیحدث استقطاب مؤقت لھذا الجزيء الذي بدوره یؤثر على الجزیئ الملاصق له فتحدث قوى التشتت (قوى لندن).
أسئلة وإجابات
(1) علل : تزداد قوى لندن بزیادة الوزن الجزیئي.
الإجابة: بسبب:
(أ) أن الجزیئات الكبیرة تحتوي على عدد أكبر من الإلكترونات مما یجعل الحصول على أقطاب لحظیة أسھل وأكثر حدوثاً.
(ب) بعد النواة وضعف قوى التجاذب معھا في الجزیئات الكبیرة یؤدي الى زیادة حركة الإلكترونات العشوائیة مما یزيد من احتمال حدوث عملیة الإستقطاب اللحظیة .
ومثال ذلك نجد أن التجاذب بین جزیئات الھكسان (C6H14) أعلى من التجاذب بين جزئيات الإيثان (C2H6) وبالتالي فالضغط البخاري للھكسان أقل ودرجة غلیانه أعلى.
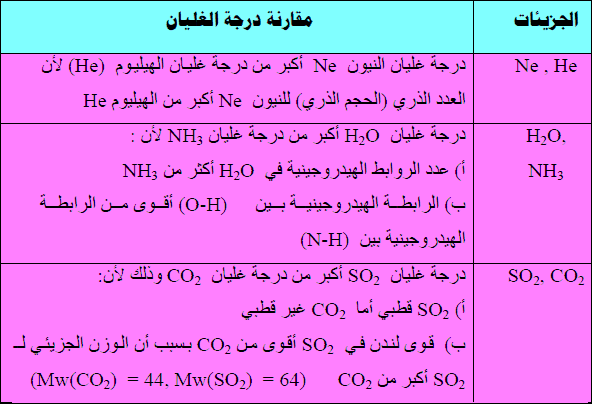
مقارنة بین درجات غلیان الغازات النادرة (النبیلة):
(2) في أي الجزیئات توجد قوى لندن؟
الإجابة:
توجد قوى لندن في جمیع الجزیئات قطبیة أو غیر قطبیة وكذلك بین الأیونات. وذلك لأن جمیع الجزیئات تحتوي على إلكترونات، لكن ھذه القوى ھي القوى الوحیدة الموجودة بین الجزیئات غیر القطبیة.
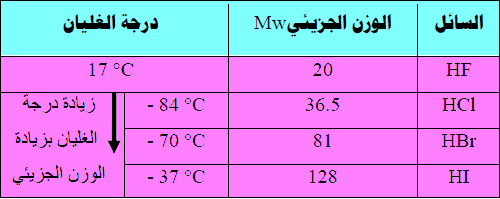
(3) علل: درجة غليان HI (19.5 Co) أكبر من درجة غليان HCl (-85 Co) مع أن قطبيةHCl أكبر من HI
الإجابة:
السبب أن قوى لندن بین الجزیئات لھا تأثیر أكبر وخصوصاً في الجزیئات ویدل ذلك على أن ذات الوزن الكبیر (Mw HI = 128 , Mw HCl = 36.5) ويدل ذلك على أن تأثیر الزیادة في الوزن الجزیئي للمادة أكبر من تأثیر القطبیة على درجة الغلیان.
ویستثنى من ذلك فلورید الھیدروجین HF حیث أنه أكبر قطبیة (HI , HCl , HBr )وله رابطة ھیدروجینیة قویة مما یؤثر ذلك على درجة غلیانه الكبیرة بالرغم من صغر قیمة الوزن الجزیئي له كما یظھر من الجدول التالي:

المراجع: أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية.
 تعرف على علم الكيمياء
تعرف على علم الكيمياء