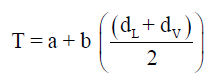
الثوابت الحرجة Critical Constants
– ومن الثوابت الحرجة للغاز هي: درجة الحرارة الحرجة – الضغط الحرج – الحجم الحرج
درجة الحرارة الحرجة Critical Temperature
– یوجد لكل غاز درجة حرارة، بحیث أنه أعلى منھا لا تكون قوى التجاذب قویة لدرجة تكفي لكي تحدث سیولة مھما كان الضغط كبیراً. وتعرف درجة الحرارة ھذه بدرجة الحرارة الحرجة للمادة، ویشار إلیھا بالرمز (cT).
– درجة الحرارة الحرجة هي أحدى الثوابت الحرجة للغاز التى قام العالم توماس أندروز بحسابها
– وتعرف درجة الحرارة الحرجة بأنھا درجة الحرارة التي لا یمكن إسالة الغاز عند درجة حرارة أعلى منھا مھما كان الضغط المؤثر كبیراً أو ھي الدرجة التي تكون المادة عند درجات حرارة أعلى منھا فقط في حالة غازیة.
– فوق درجة الحرارة الحرجة تكون حركة الجزیئات عنیفة، لدرجة أنه مھما كان الضغط عالیاً، فإن الجزیئات تشغل كل الحجم المتاح على ھیئة غاز. وتعتمد قیمة درجة الحرارة الحرجة على مقدار قوى التجاذب بین الجزیئات.
الضغط الحرج Critical Pressure
– الضغط الحرج ھو أقل ضغط ضروري (یجب أن یبذل) لإسالة الغاز عند درجة الحرارة الحرجة.
– فوق درجة الحرارة الحرجة فإنه لا یمكن لأي كمیة من الضغط أن تحدث سیولة.
الحجم الحرج Critical Volume
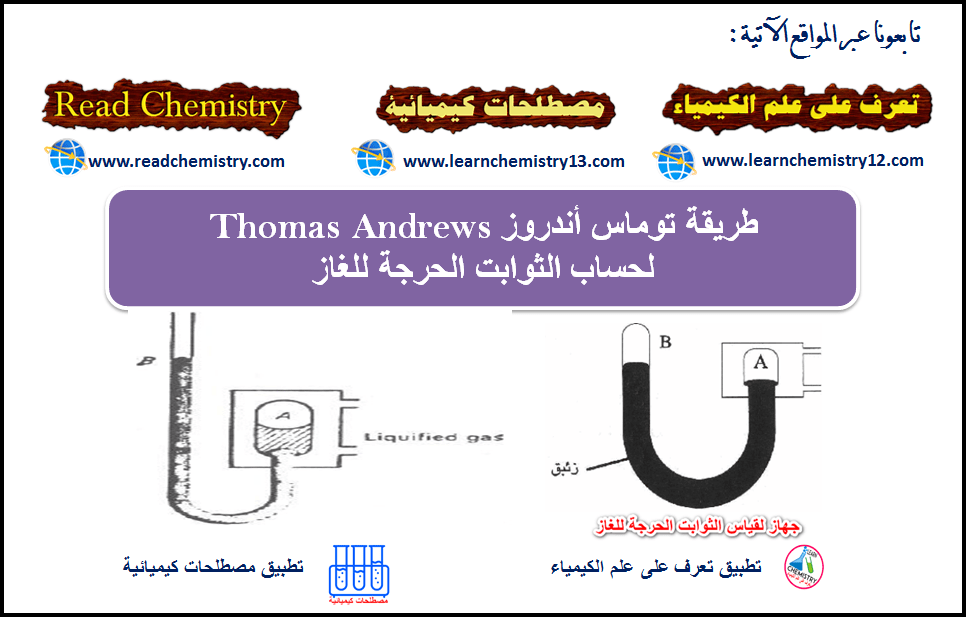
التجربة العملية لحساب قيم الثوابت الحرجة Measurement of Critical Constants
خطوات طريقة أندروز لحساب الثوابت الحرجة للغاز
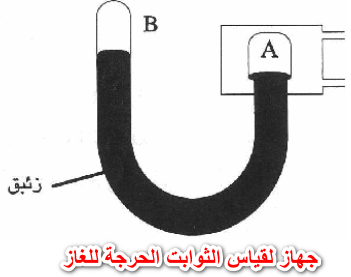
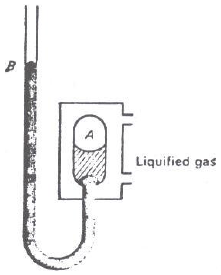
الضغط الحرج من قیاس فرق سطحي الزئبق في . المانومتر، وإضافته جبریاً للضغط الجوي.
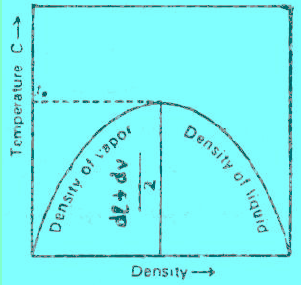
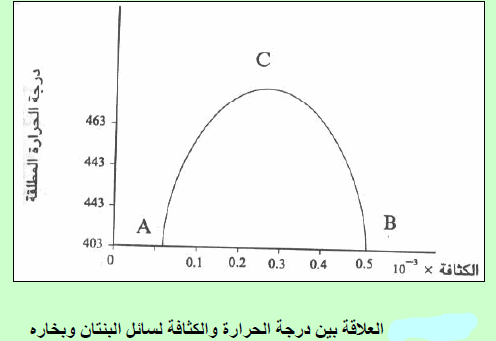
ولتعیین قیمة الحجم الحرج باستخدام قاعدة كایلیتیت، وما ثیاس (Cailletet and Mathias). وتنص القاعدة على أنه عندما تخطط علاقة بیانیة بین القیم المتوسطة لمجموع كثافتي السائل والبخار المشبع لأي مادة مقابل درجة الحرارة ، فإن المخطط الناتج یكون عبارة عن خط مستقیم كما بالشكل التالي:
Densities وطبقاً لقانون كایلتیت وماثیاس فإن معادلة الخط هي:
– عند درجة الحرارة الحرجة يكون dL = dV = dC حيث dC هى الكثافة الحرجة
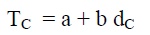
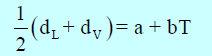
 |
| الشكل (1) |
(أ) الكثافات المبینة على المنحنى (ِAC) تمثل كثافة البخار المشبع وعلى المنحنى (BC) كثافة السائل وعند درجات حراریة مختلفة. وإن التقاء ھذین المنحنیین في النقطة (C) والتي تمثل تماثل كثافة السائل مع بخاره ، وإن الكثافة في ھذه النقطة تمثل الكثافة الحرجة critical density
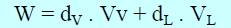
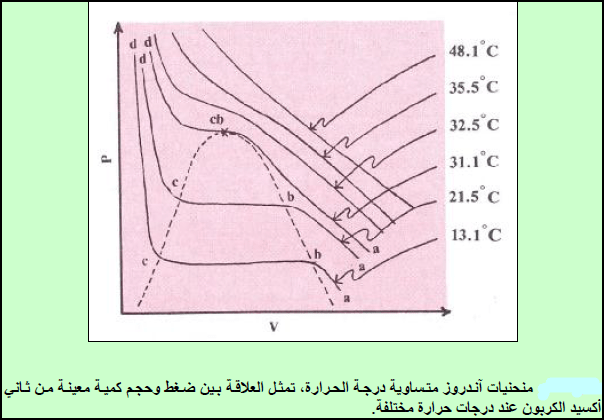
شرح آخر لتجربة العالم توماس آندروز (Thomas Andrews) لإسالة الغازات
معرفة شروط إسالة غاز ما.
– من الشكل السابق حيث يمكن ملاحظة ما يلي:
(أ) يسلك الغاز عند (48.1 Co)سلوكاً قریباً من سلوك الغاز المثالي ولكنه یبدأ في الحیود عنه أكثر فأكثر كلما انخفضت درجة الحرارة.
(ب) عند درجات الحرارة المنخفضة تبدأ بالظھور ثلاث مناطق متمیزة لكل منحنى ھي المناطق التالیة:
(1) المنطقة (ab): تمثل الحالة التي یتناقص فیھا الحجم بزیادة الضغط وھي الحالة التى يكون عندها CO2 غازاً.
(2) المنطقة (cd): تمثل الحالة التي یتغیر فیھا الحجم بشكل طفیف بزیادة الضغط وھي الحالة التى يكون عندها CO2سائلاً.
(3) المنطقة (bc): وتمثل الحالة التي یتناقص فیھا الحجم عند ضغط ثابت، وتمثل الحالة التى يبدأ فيها (CO2) عند (b)بالتحول من غاز إلى سائل والتى يكتمل فيها عند (c) تحوله إلى سائل وهذا يعنى أنها تمثل ظروف تحول (CO2) من حالته الغازية إلى السائلة.
(جـ) أن الضغط الذي یبدأ الغاز عنده بالتحول الى سائل یقل كلما كانت درجة الحرارة منخفضة.
(د) بناء على ما ورد في الفقرة (ج ) فإن الحجم (عند الضغط الذي تبدأ به عملیة تحول الغاز الى سائل) یزداد بانخفاض درجة الحرارة.
(ھ) من بدء تحول الغاز الى سائل الى نھایة ھذا التحول فإن ΔP = 0 ومنه:
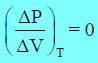
النتائج المھمة من الملاحظات السابقة
تفسير إسالة الغازات باستخدام النظرية الحركية للغازات
– فالفرق الھام بین الحالتین السائلة والغازیة لثاني أكسید الكربون یكمن بشكل أساسي في اختلاف قوى التجاذب بین الجزیئات في الحالتین. ولا شك أنھا أعلى في الحالة السائلة منھا في الحالة الغازیة.
– ولذلك یمكن القول أن تحویل الغاز الى سائل یتم ببساطة عبر زیادة قوى التجاذب بین الجزیئات الأمر الذي یمكن انجازه عبر تقلیل المسافة بین الجزیئات وھذا یتحقق بزیادة الضغط، ولكن في نفس الوقت وحتى لو قلت المسافة بین الجزیئات بزیادة الضغط فإن طاقة حركة الجزیئات ستظل كما ھي لأنھا لا تعتمد إلا على درجة الحرارة حیث:
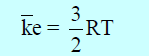

 تعرف على علم الكيمياء
تعرف على علم الكيمياء