طرق إسالة الغازات Liquefaction Methods of Gases
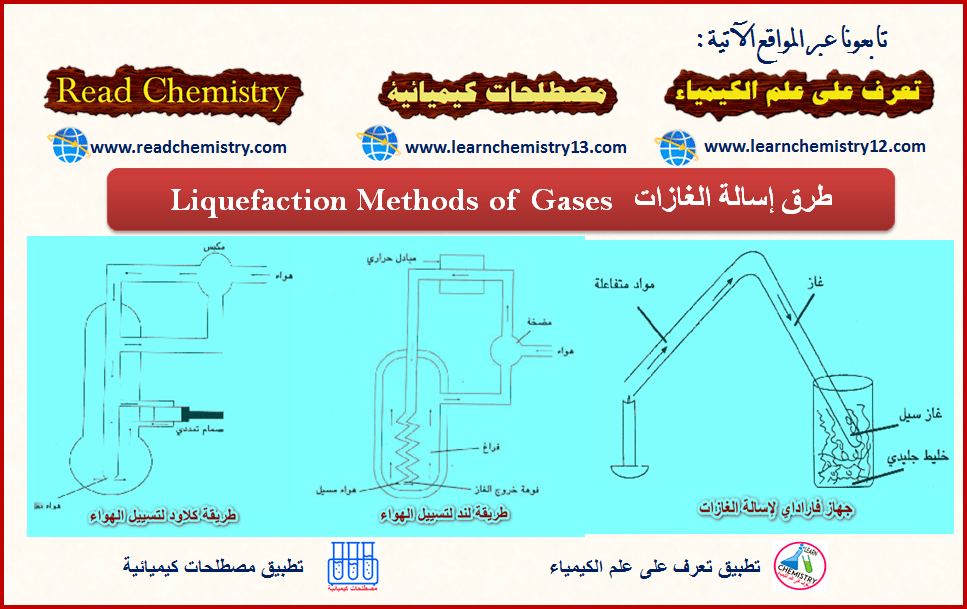
طرق إسالة الغازات Liquefaction Methods of Gases
– تختلف السوائل عن الغازات في تعبیر القوى المتبادلة بین الجزیئات، ومتوسط الممر الحر للجسیمات المكونة.
(1) فى حالة الغازات: تكون القوى المتبادلة بین الجزیئات ضعیفة جداً في الغازات، وأن جزیئات الغاز لھا حریة الوجود منفردة، وكمیة الطاقة الحركیة للغازات عالیة جداً وجزیئاتھا تكون في حركة سریعة ومتواصلة، في جمیع الإتجاھات الممكنة (حركة مستمرة سریعة وعشوائیة).
(2) فى حالة السوائل: السوائل تتمیز عن الغاز بقوة تجاذب وقوة التصاق أكبر ، وھذه القوى لا تسمح للجزیئات بأن یكون لھا حركة انتقالیة بنفس الحریة الموجودة في الحالة الغازیة.
وبذلك فإن جزیئات السائل محدودة الحركة، وأن متوسط الممر الحر لھا أقصر بكثیر منه في الحالة الغازیة.
– وعلى العموم فإن خفض درجة حرارة الغاز، یؤدي الى تقلیل الطاقة الحركیة للجزیئات. كما أن الضغط یؤدي في النھایة الى حدوث تلاصق بینھما، وعندئذ یمكن تحویل الغاز الى سائل.
– تتم إسالة الغازات عند الظروف التي تسمح لقوى التجاذب بین جزیئات الغاز لربط الجزیئات ببعضھا البعض في الحالة السائلة. وإذا زاد الضغط على الغاز تقترب الجزیئات من بعضھا ویكون تأثیر قوى التجاذب كبیراً (الضغط یجلب الجزیئات في تلاصق مع بعضھا البعض)، وحیث أن تأثیر قوى التجاذب ستقاومه حركة جزیئات الغاز فإن خفض درجة الحرارة (التبرید) یقلل من طاقة حركة الجزیئات وبالتالي تقل سرعة الجزیئات مما یساعد على إسالة الغاز (التبرید یقلل من الضغط اللازم لعملیة التسییل).
– ومن ھنا فإن الإسالة تتم عند الضغوط العالیة ودرجات الحرارة المنخفضة، ولكن یكون تأثیر درجة الحرارة ھو السائد الى حد كبیر بالمقارنة بتأثیر الضغط ، وذلك لأننا سبق وأن رأینا أن لكل غاز درجة حرارة حرجة، لا یمكن إسالة الغاز عند درجة حرارة أعلى منھا مھما كانت قیمة الضغط الواقع علیه.
عملية الإسالة عكس عملية التبخير
– إن عملیة التسییل معاكسة لعملیة التبخیر.
– تعتمد عملية الإسالة على طبیعة الغاز فأبخرة المواد التي تكون سائلة في أو قرب درجة حرارة الغرفة والضغط الجوي تتكثف بسھولة بالتبرید.
– وأما المواد التي تكون سائلة في درجات حرارة منخفضة فإنھا تتكثف إما بواسطة الضغط أو بالضغط والتبرید.
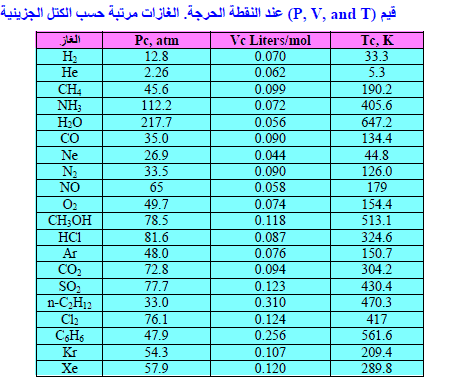
القيم الحرجة لإسالة الغازات
– قد وجد أن الضغط وحده لا یكفي لتسییل غازات معینة مثل ما یعرف بالغازات الدائمة كالأكسجین (O2) والهيدروجين (H2) والهيليوم (He) والنيتروجين (N2) والتي لھا درجات حرارة حرجة منخفضة جداً، ولكن بالضغط العالي وتبریدھا الى درجات حرارة أدنى من درجات حرارتھا الحرجة أمكن تسییل ھذه الغازات.
– یوجد لكل غاز درجة حرارة لا یمكن إسالته فوقھا مھما زاد الضغط وتعرف ھذا الدرجة بدرجة الحرارة الحرجة critical temperature والضغط الحرج critical pressure ھو الضغط اللازم لإسالة الغاز عند درجة الحرارة الحرجة للغاز.
– الجدول التالي یمثل درجات الحرارة الحرجة والضغط الحرج لبعض الغازات:
طريقة فاراداي Faraday’s Method
– كان فاراداي، عام (1823)، أول من قام بدراسة منتظمة لإسالة الغازات. (أول من حاول الربط بین التبرید، والضغط لإسالة الغازات المختلفة).
– حیث تمكن من اسالة العدید من الغازات مثل ثاني أكسید الكربون CO2 وثاني أكسید الكبریت SO2 وغاز الكلور Cl2 وأكسید النیتروجین NO وغیرھا وذلك بزیادة الضغط وخفض درجة الحرارة، واستخدام مخالیط مبردة.
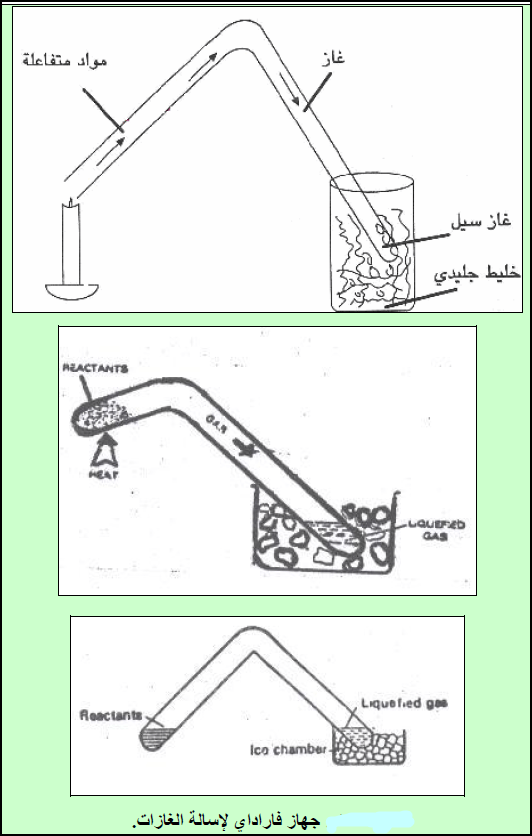
– ولقد استخدم فاراداي الجھاز المبسط الموضح بالشكل التالي:
شرح جهاز فارادي لإسالة الغازات
(1) استعمل فارادي أنبوبة زجاجیة على شكل حرف (V) حیث یحضر الغاز بوضع المادة في أحد طرفیھا وتسخینھا في حین یكون الطرف الآخر مغموساً في وعاء به ثلج أو مخلوط مبرد.
(2) عند تصاعد الغاز داخل الأنبوبة نتیجة التسخین نلاحظ زیادة في الضغط ویھرب الغاز الى الطرف الآخر من الأنبوبة والمغموس في المخلوط المبرد،
النتيجة: یتحول جزء من الغاز نتیجة لزیادة الضغط وانخفاض درجة حرارته الى الحالة السائلة (یسال الغاز تحت تأثیر ضغطه الذاتي).
عيوب طريقة فارادي
– لقد تمكن فاراداي بھذه الطریقة البسیطة من إسالة بعض الغازات مثل HCl, Cl2,, H2S, CO2, SO2, NH3
– فشل في إسالة بعضالغازات مثل: N2 , O2, 2He, H بالرغم من أنه أثر علیھا بضغوط عالیة جداً (حتى 3000 (atm ولذلك عرفت بالغازات الدائمة permanent gases
– فشلت الجھود التي قام بھا آخرون لتسییل ھذه الغازات وغیرھا بالرغم من الوصول الى ضغوط عالیة جداً والسبب في ذلك یعود الى أن قوى الترابط بین جزیئات ھذه الغازات ضعیفة جداً (قیمة الثابت لمعادلة فان درفالز منخفضة).
محاولات آندروز لتفشير فشل طريقة فارادي
– قد استطاع أندراوس ) 1869 (Andrews أن یبین أن لكل غاز ظروف خاصة في درجة حراریة وضغط وھذه تدعى بالظروف الحرجة.
– بعد اكتشاف أندراوس للظاھرة الحرجة توصل الى استنتاج وھو أنه لا بد من تبرید الغاز الى ما دون درجة حرارته الحرجة قبل إسالته (یلزمھا تبرید حاد وضغط عال الى حد بعید)، وفي حالة عدم الوصول الى درجة الحرارة الحرجة فإن الغازات الدائمة لا تتحول الى حالة سائلة مھما كان الضغط المسلط علیھا. وأن الغازات التي استطاع فاراداي تسییلھا لھا درجات حرجة مقاربة لدرجات حرارة الجو الاعتیادي.
– ومن ھنا فقد فسر آندروز السبب في فشل فاراداي في إسالة ما یعرف بالغازات الدائمة بأن فاراداي فشل في إسالتھا لأن درجة حرارتھا الحرجة منخفضة جداً ولم یتمكن من الوصول الى ھذه الدرجة الحرجة حینذاك لانخفاضھا الكبیر.
طريقة بكتيت (Pictet Method (1877
– نجح العالم بكتيت (1877) في إسالة الأكسجين (O2) والهيدروجين (H2) لأول مرة. وأوضح أنھما لم یعودا دائمین، وذلك بتطبیق مبدأ الشلالات أو متوالیة من التبرید (بطریقة تتابعیة في التبرید بإعادة الضغط والتبرید).
– عند تبخیر سائل غازي (غاز مسال) تبخیراً سریعاً أمكن الوصول الى درجة حرارة منخفضة.
– فمثلاً عند (تبخیر ثاني أكسید الكبریت السائل) أمكنه الحصول على درجة حرارة (-56 Co) وهذه الدرجة كافیة (لإسالة غاز ثاني أكسید الكربون (CO2) وعند تبخير (CO2) أمكنه الوصول إلى درجة حرارة (-130 Co) وھذه الدرجة كافیة لإسالة غاز الأكسجین (O2) المضغوط.
– استطاع أندروز باستخدام طریقة الشلالات (إعادة الضغط والتبرید) التوصل الى درجات حرارة أدنى من ذلك.
– أدنى درجة حرارة أمكنه التوصل إلیھا (-218 Co) للأكسجین وذلك بتبخیر الأكسجین السائل و (-228.71 Co) ولكن ھذه الدرجة أعلى بكثیر من درجة الحرارة للنیون (TC = – 228.71 °C) Ne والهيدروجين (TC = – 239.9 °C) والهيليوم (TC = – 267.84 °C)
– للتوصل الى ھاتین الدرجتین المنخفضتین تستخدم طریقة التتابع (الضغط – التبرید) المستمر بإحدى الطریقتین التالیتین:
(1) طریقة لیند وھامبسون (Lind and Hampson’s Method) 1895م
بتطبیق تأثیر جول طومسون (Joule – Thomson Effect) لإحداث التبرید (بضغط الغاز ثم السماح له بالتمدد فتقل درجة حرارة الغاز).
(2) طریقة كلود وھیلان (Cloud’s and Haylan’s Method)
والتي تعتمد على إحداث التبرید نتیجة للتمدد الأدیاباتي الفجائي .(Adiabatic Expansion).
الطريقة الأولى لتسييل الغازات: طريقة ليند و هامبسون Lind-Hampson’s Method
– تعتمد طریقة لیند وھامبسون على تأثیر جول- طومسون والذي ینص على أنه:
(عندما یسمح لأي غاز موجود تحت ضغط عال بالتمدد المفاجيء في منطقة ذات ضغط منخفض، فإن درجة حرارته سوف تنخفض. ویبرد الغاز بسبب حقیقة أنه أثناء التمدد سوف تستغل الطاقة الحركیة للغاز المتمدد في التغلب على قوى التجاذب بین الجزیئات حیث أن الغاز یقوم بشغل داخلي).
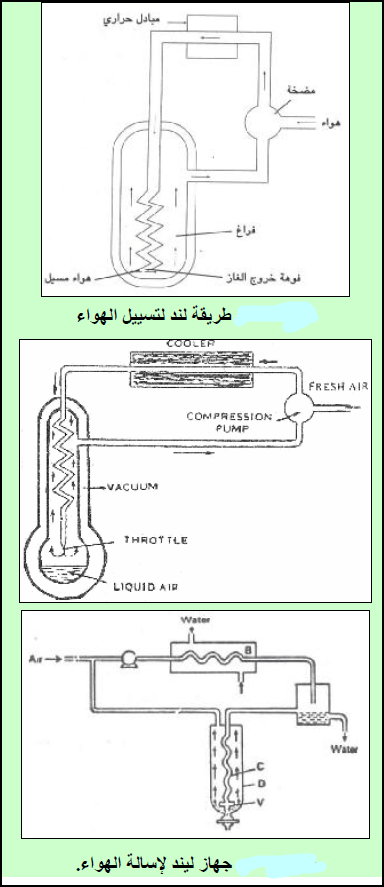
– الأشكال التالية توضح الجھاز الذي استخدمه لیند في إسالة الھواء:
– استطاع لیند تسییل الھواء وذلك بالتمدد المفاجئ للغاز المضغوط تحت ضغوط عالیة مما ینتج عنه انخفاضاً في درجة حرارة ذلك الغاز.
– إن جزیئات الغاز الموجودة تحت ضغط عال تكون متقاربة بعضھا من البعض الآخر مما یستوجب وجود قوى تجاذبیة بین ھذه الجزیئات، وعندما یسمح لھذا الغاز الموجود تحت ضغط عال بالتمدد بمساحة یكون فیھا الضغط أقل فإن جزیئات ھذا الغاز تحاول فك الإرتباط فیما بینھا ویتم ذلك بامتصاص كمیة كبیرة من الطاقة وفي نفس الغاز مما ینتج عن ذلك انخفاضاً في درجة حرارة ذلك الغاز.
خطوات العمل
(1) ینقى الھواء المراد تبریده من ثاني أكسید الكربون CO2 والمواد العضویة والرطوبة.
(2) یضخ الھواء في أنبوبة حلزونیة (جھاز ضغط (Compressor حيث يضغط إلى ضغط حوالي (200 atm) (يزيد عن 2.00 × 107 N/m2) . ونتيجة لارتفاع الضغط فإن درجة حرارة الھواء تزداد (تتولد حرارة أثناء الضغط). وأثناء عملیة الضغط فإن أي بخار للماء موجود في الھواء سوف یتكثف ویزاح.
(3) ولما كان الغرض من ھذه العملیة تخفیض درجة الحرارة ولیس زیادتھا فإن ھذا الھواء الذي ارتفعت درجة حرارته یتم التخلص من حرارته حیث یمرر في مبادل حراري heat exchanger (أنابیب نحاسیة حلزونیة مبردة) لتخفیض درجة الحرارة.
حیث یمرر ھذا الھواء في أنبوب حلزوني (c) ينتهى بفوهة صغيرة جداً لینتھي بالمحیط ذي الضغط المنخفض (الغرفة D ) ليصل ضغطها إلى حوالى (1 atm) وذلك بضبط الصمام (V) (العملیة ھنا ھي عملیة تمدد مفاجئ). ونتیجة للتمدد سوف تھبط درجة حرارة الغاز (تنخفض درجة حرارة الھواء) الى حوالي (-78 Co) .
والسبب في تخفیض درجة الحرارة أنه عند عملیة التمدد سوف یستغل الغاز جزءاً من طاقته الداخلیة للتغلب على قوى التجاذب بین الجزیئات الناشئة عن الضغط العالي، فیبرد الھواء.
(4) یمرر الھواء الذي تم تبریده بھذه الطریقة مرة ثانیة فوق الحلزونات النحاسیة (c) وبھذه الطریقة سوف یؤدي الى تبرید الغاز الداخل الى درجة أقل حتى قبیل تمدده.
(5) بعد إتمام الدورة عدة مرات (یعود الى الضاغطة (compressor تعاد العملية مرة ثانیة وثالثة …الخ حتى الوصول الى الضغط ودرجة الحرارة الحرجین حیث یتحول الى سائل)، فإن درجة حرارة الغاز المتمدد سوف تصبح منخفضة للغایة لدرجة أن الھواء السائل سوف یتدفق عبر الصمام (V) أما الھواء الذي لم یتكثف بعد، فإنه یعاد مرة ثانیة الى جھاز الضغط حیث تكتمل الدورة.
النتائج
– لقد نجح لیند في إسالة بعضالغازات مثل (N2 , O2) .وأما في حالة كل من (H2 , He) لا یمكن إسالتھا عند ظروف درجة الحرارة العادیة حیث أن قوى التجاذب بین جزیئاتھا منخفضة لذلك فإن ھذه الغازات صعبة الإسالة كما وأنھا تسلك سلوكاً شاذاً عن السلوك المعتاد للغازات الأخرى حیث تبین فیما بعد أنه بزیادة الضغط ترتفع درجة حرارتھما عند التمدد المفاجيء (بینما بردت معظم الغازات أثناء تمددھا، إلا أن غازي الھیدروجین والھیلیوم قد سخنا) وإن ھذه الغازات یمكن تبریدھا بتأثیر جول- طومسون (Joule Thomson – Effect)
– حیث تبین بالفحص أنه یمكنھما أن یسلكا نفس مسلك الغازات الأخرى إذا كانا قد تم تبریدھما، قبل التمدد الى ما دون درجتي حرارة تحولھما حیث درجة حرارة التحول للهيدروجين H2 (-80 Co) وللهيليوم He (-240 Co)
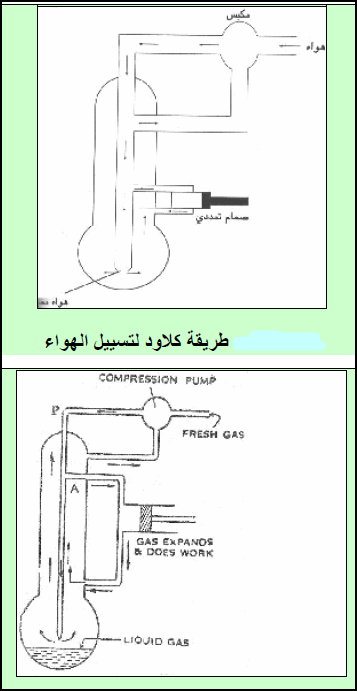
الطريقة الثانية لتسييل الغازات: طريقة كلود – هيلان Cloud – Haylan’s Method
–في ھذه الطریقة یسمح للھواء المضغوط لكي یعمل شغلاً میكانیكیاً أثناء تمدده الأدیاباتیكي (الأدیاباتي) حیث یكون الغاز معزولاً حراریاً. إذ یضغط الغاز الى حوالي (200 atm) ثم بعد ذلك یسمح له بالتمدد ضد مكبس یحبسه. وأثناء التمدد ضد المكبس، فإن على الغاز أن یقوم بشغل میكانیكي (شغل خارجي).
– ونتیجة لھذا الشغل سوف تزول الطاقة الحركیة لجزیئات الغاز، وتنخفض بالتالي درجة حرارته، ثم یقسم الغاز المنبثق الى تیارین – حیث یسمح لأحدھما بالتمدد ضد المكبس (یعمل شغلاً خارجیاً). ویمرر الآخر خلال جھاز خانق (ضیق جداً). ثم یسمح له بالتمدد حیث تھبط درجة حرارته بتأثیر جول- طومسون (یعمل شغلاً داخلیاً).
– تعتبر طریقة كلود تطویراً لطریقة لیند. وذلك نتیجة للحقیقة بأنه في طریقة كلود، لا یضیع الشغل الناتج عن تمدد الھواء ھباء، بل يستخدم ھذا الشغل في تشغیل الجھاز الضاغط.
– في ھذه الطریقة فإن التبرید سیكون أكبر بالمقارنة بما یحدث في الطریقة الأولى (طریقة لیند – ھامبسون).
– بھذه الطریقة أمكن التوصل الى إسالة جمیع الغازات، حتى أنه في الآونة الأخیرة 1908م توصل العالم كمرلينغ أونيس Kammerlingh Onnes إلى إسالة غاز الهيليوم (He).
خطوات العمل
تتضح طريقة التشغيل من خلال الجهاز التالي:
(1) حیث یضغط الھواء بضاغط فیمر خلال الأنبوبة (P). وينتقل الهواء إلى المنطقة (A)حیث یتمدد الغاز ویعمل شغلاً على مكبس في آلة.
(2) ثم یضغط الغاز مرة أخرى بواسطة المكبس الآلي حیث یذھب ثانیة الى غرفة الإسالة ویبرد الغاز مرة أخرى.
(3) باستخدام ضاغط الھواء مرة أخرى، فإنه سیمر خلال الأنبوبة لیصل الى منطقة الغاز السائل. أما ما یتبقى من غاز فسوف یسحب مرة أخرى بواسطة مكبس ساحب.
(4) وتتوالى ھذه العملیة عدة مرات حتى نصل في النھایة الى مراحل مختلفة في التبرید.
الطرق الحديثة لإسالة الغازات
– ولا زالت الطرق والتجارب المعملیة والعملیة مستمرة بھدف ایجاد أفضل الطرق المعملیة والعلمیة لإسالة الغازات.
– ففي عام (1927) تمكن العالمان ديباي وجياك (Debye and Giaque) من التوصل إلى تبريد شديد جداً حتى أقل من (1.0 K) باستخدام طریقة أفضل للتبرید وھي إزالة المغناطیسیة الأدیباتیة (adiabatic demagnetization) من مواد ممغنطة.
– وقد لوحظ ھذا التأثیر بأفضل ما یمكن عند درجات حرارة منخفضة وباستخدام مواد غیر حدیدومغناطیسیة.(not ferromagnetic) . ویستخدم عادة في ھذه الطریقة مواد بارامغناطیسیة (paramagnetic) مثل كبریتات الجادولینیوم وفلورید السیریوم……الخ. وتبین أنھما أفضل بكثیر من المواد الحدیدو- مغناطیسیة (ferromagnetic)
استعمالات الغازات المسالة Uses of Liquefied gases
لإسالة الغازات أھمیة كبیرة في كل من الصناعة، والمعامل نظراً للتطبیقات العدیدة للغازات المسالة.
(1) باستخدام الغازات المسالة، من الممكن الحصول على تفریغ عال.
(2) یمكن استخدام الھواء المسال في عملیة تجفیف الغازات وتنقیتھا.
(3) ویمكن الحصول على غازات عدیدة من الھواء السائل مثل (Kr, Ne, Ar, O2) على نطاق واسع. وذلك بالتقطیر التجزیئي للھواء المسال.
(4) كما أن الغازات سھلة الإسالة مثل (NH3 , SO2) ثنائي فلورو- ثنائي كلورو المیثان (فریون) (Cl2CF2) تستخدم في أغراض التبرید.
(5) یستخدم خلیط الأكسجین السائل مع بودرة الفحم في صناعة المفرقعات.
(6) یستخدم الأكسجین والهيليوم على نطاق واسع في أغراض اللحام.
(7) يستخدم الكلور (Cl2) كمزيل للألوان.
المراجع: أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية.