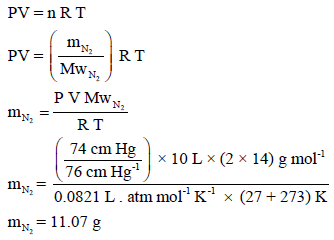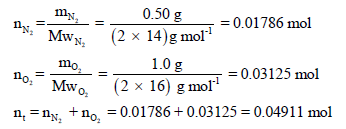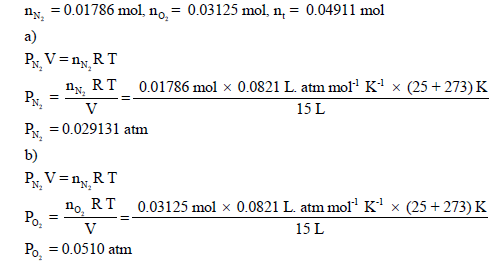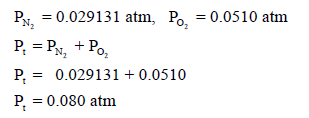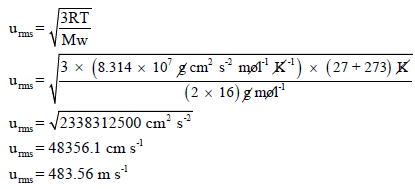فى هذا الموضوع سوف نتطرق إلى (10) مسائل محلولة عن خواص الغازات بأفكار مختلفة وحلول بسيطة وطرق سهلة.
كما تم التطرق إلى (10) مسائل محلولة عن خواص الغازات – الجزء الثاني
مثال (1):
احسب عدد مولات الهيدروجين الموجودة فى (18 L) من الغاز عند ضغط قدره (70 cm.Hg) ودرجة حرارة (27Co). علماً بأن (R = 0.0821 L. atm/K . mol)
الحل:
بتطبيق القانون العام للغازات المثالية:
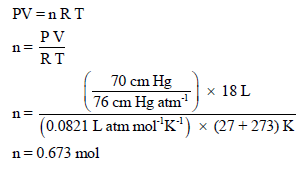
مثال (2):
احسب وزن (10 L) من غاز النيتروجين في درجة حرارة (27 Co) وضغط (74 cm Hg) علماً بأن (R = 0.0821 L. atm/K . mol)
الحل:
بتطبيق القانون العام للغازات المثالية:
مثال (3):
خليط غازي يحتوى على (0.5 g) من النيتروجين (1.0 g) من الأكسجين موجود في أسطوانة حجمها (15 L) في درجة حرارة (25 Co) احسب:
(أ) عدد مولات كل غاز.
(ب) الضغط الجزئي لكل غاز.
(جـ) الضغط الكلي لخلیط الغازات.
الحل:(أ) عدد مولات كل غاز:
(ب) نحسب ضغط كل غاز على حدة بالتطبیق في القانون العام للغازات المثالیة:
 مثال (4):
مثال (4):
احسب معدل الجدز التربيعى لسرعة جزئيات الأوكسجين (O2) في درجة حرارة (27 Co) علماً بأن (R = 8.314 × 107 erg/molK) حيث (2(erg = 1g . cm2/s علماً بأن (AWO= 16)
الحل:
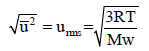
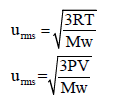
حيث Mw هو الوزن الجزیئي للغاز وتعتمد وحدته على وحدة ثابت الغازات (R)
** فإذا كانت وحدة (R = 8.314 J/mol K = 8.314 kg m2/s2 mol K) فإن وحدة الوزن الجزيئي (Mw) تكون Kg/mol لأن الثابت R به وحدة Kg
مثال (5):
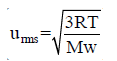
حيث أن Mw هو الوزن الجزيئي ويكون بوحدة Kg/mol واختيار هذه الوحدة بسبب أن قيمة الثابت (R)المعطاة هي:
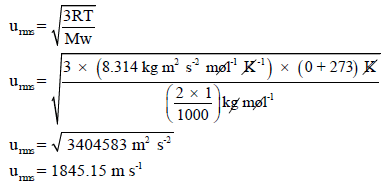
طريقة حل أخرى:
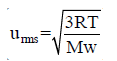
يمكن التعويض عن قيمة (RT) بالقيمة (PV) لتصبح العلاقة:
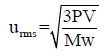
– لكن المشكلة تكمن في معرفة الوحدات الصحيحة لقيم V , P من أجل التعويض بها في العلاقة للحصول على وحدة للسرعة تساوى cm/s أو m/s
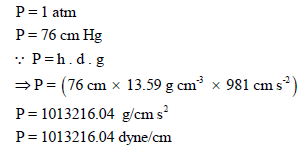
وبالتالي نعوض بقیمة الوزن الجزیئي بالوحدة (g/mol):
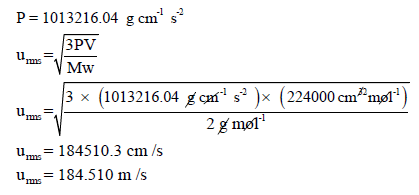
مثال (6):
وبتطبیق العلاقة:
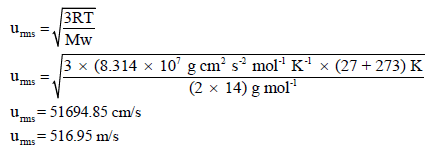
وإذا عوضنا بقيمة:
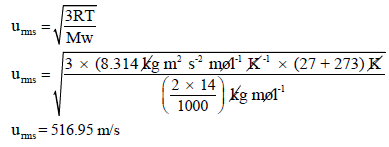
طريقة أخرى للحل:
ویمكن حل المسألة بالقانون:
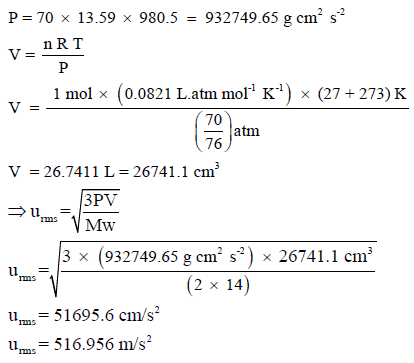
مثال (7):
احسب وزن:
(أ) جزيء واحد من غاز الأكسجین (O2)
(ب) جزيء واحد من غاز ثاني أكسید الكربون (CO2)
علماً بأن الكتل الذرية : (O= 16 , C= 12) وعدد أفوجادرو NA= 6.023 × 1023
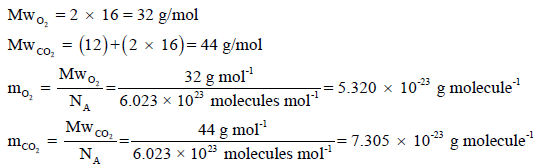
مثال (8):
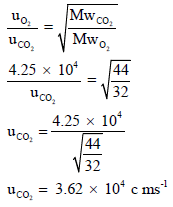
مثال (9):
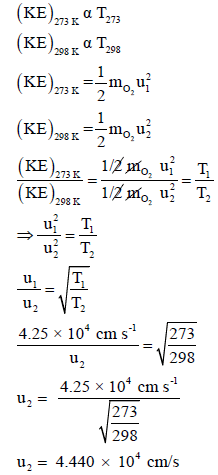
مثال (10):
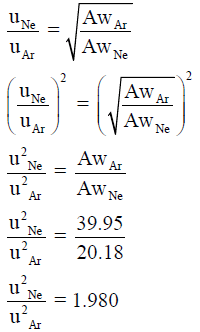
المراجع: أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية.
 تعرف على علم الكيمياء
تعرف على علم الكيمياء