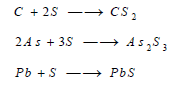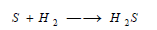محتويات الموضوع
ما هو عنصر الكبريت؟ What is Sulphur element
– هو عنصر من عناصر الجدول الدوري ، العدد الذري له = 16 العدد الكتلي = 32
– التوزيع الإلكتروني له كالتالي: 1S2 , 2S2 2P6 , 3S2 3P4
– هو عنصر لافلزي ذو لون أصفر زاهي ، لا طعم له ولا رائحة، هش ينكسر بسهولة.

– عنصر رديء التوصيل للحرارة لدرجة أن مسكه باليد وتقريبه من الأذن يؤدي إلى سماع طقطقة ناتجة عن تمدد السطح الخارجي بحرارة اليد دون تأثر الأجزاء الدا خلية مما يؤدي إلى حدوث تشققات دقيقة.
– يوجد في أشكال عدة تسمى المتأصلات، وأكثرها شيوعا المعين الشكل والغير المتبلور أو البلاستيكي.
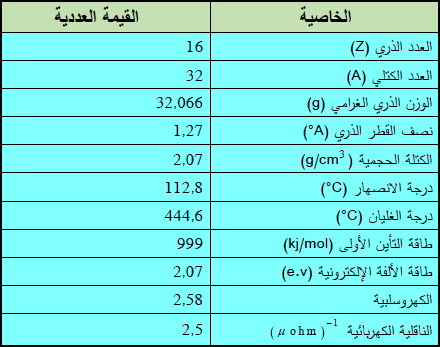
– الجدول التالي يوضح بعض الخواص العامة لهذا العنصر:
اكتشاف الكبريت ووجوده في الطبيعة Discovery of Sulphur
– عرف هذا العنصر قبل الميلاد.
– اشتق أسمه من اللاتينية (Sulphurium) بمعنى الحجر الحارق.
– يوجد بكميات كبيرة على حالة منفردة وبالخصوص في الأماكن البركانية نتيجة تفاعل غاز كبريتيد الهيدروجين وثاني أكسيد الكبريت اللذين يتصاعدان ضمن الغازات الأخرى.
– كما يوجد متّحداً مع الكثير من الفلزات مكوناً كبريتيداتها وأكثرها انتشاراً: بيريت الحديد FeS2 ، بيريت الحديد والنحاس CuFeS2 والجالينا PbS.
– علاوة على ذلك فأن الكبريت يوجد إيضاً على هيئة كبريتات أهمها كبريتات الكالسيوم المائية CaSO4.2H2O
– يكون حوالي 0.03 % من وزن القشرة الأرضية، كما تحتوي المحيطات على حوالي 0.09 % من الكبريـت أهمها على هيئة كبريتات.
– بالإضافة إلى ذلك فأنه من الكبريتات الهامة الموجودة في الطبيعة: كبريتات الكالسيوم وكبريتات الباريوم.
تحضير الكبريت Preparation of Sulphur
– كان يستحصل قديماً عن طريق حرق قسم من الكبريت لينصهر الباقي ويسيل بعيداً عن الشوائب الصلبة.
– أي أن هذه الطريقة تعتمد على استعمال الكبريت كوقود نظراً للكلفة الباهظة لأنواع الوقود الأخرى بالنسبة للكبريـت.
– وتعطي هذه الطريقة نقاوة للكبريت بحوالي 97.5 % ويمكن إجراء عملية التقطير للكبريـت الناتج والحصول عليه بنقاوة أعلى.
– يُحضر أيضاً بإختزال كبريتات الكالسيوم بالكربون كما بالمعادلات الآتية:
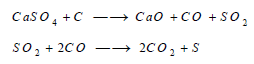
الخواص الكيميائية للكبريت Chemical properties of Sulphur
(1) التفاعل مع الأكسجين
Reaction between Sulphur and Oxygen
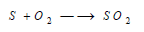
(2) التفاعل مع الأحماض
AcidsReaction between Sulphur and
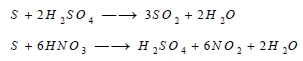
(3) التفاعل مع القواعد
basesReaction between Sulphur and
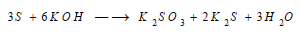
(4) التفاعل مع أشباه المعادن
non-metalsReaction between Sulphur and
– يتحد الكبريت بالتسخين بصورة مباشرة مع الكربون والفوسفور والزرنيخ ومع معظم المعادن مشكلاً كبريتيدات هذه المعادن كما بالمعادلات الآتية:
– كما يتحد مع الهالوجينات مشكلاً مركبات كما يلي:
SCl4 – S2Cl2 – SF4 – SF6
– يتحد مصهور الكبريـت مع غاز الهيدروجين مشكلاً غاز كبريتيد الهيدروجين كما بالمعادلة الآتية:
استخدامات الكبريت Uses of Sulphur
(1) يستخدم في صناعة أعواد الثقاب والبارود الأسود، وصناعة الأصباغ والدهانات والورق والمنسوجات.
(2) كما يستخدم في صناعة بعض أنواع الأسمدة والمتفجرات والمطاط والبطاريات ومبيدات الفطر.
(3) يعد أهم مادة كيميائية تجارية في العالم، فهو يستخدم في تحضير حمض الكبريتيك . وبعض المواد الكيميائية المستخدمة في أفلام التصوير.
(4) بالإضافة إلى ذلك فأنه يدخل في صناعة الأدوية الخاصة بعلاج الأمراض الجلدية واضطرابات الهضم.
تأثير الكبريت على جسم الإنسان
يحتوي جسم الإنسان على 14 جرام من الكبريت، فهو:
(1) يساعد البروتينات في المحافظة على تركيبها.
(2) كما يساعد الجسم على إخراج المواد الضارة منه وينظم عملية تخثر الدم.
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.
 تعرف على علم الكيمياء
تعرف على علم الكيمياء