التهجين فى الكيمياء Hybridization in Chemistry

تعريف التهجين Hybridization
يعطى التهجين تفسيراً لطبيعة الأفلاك الذرية وكيفية اتحادها لتكوين الأفلاك الجزيئية وهى عبارة عن عملية تداخل بين أفلاك الذرة الواحدة المتقاربة في الطاقة ينتج عنها افلاك جديدة متساوية في الطاقة والشكل.
تعريف الفلك الجزيئي Molecular orbital
المستقل.
– تتم عملية التهجين بعد إثارة الذرة – نتيجة لامتصاص طاقة – حيث ينتقل إلكترون من فلك فرعي أقل في الطاقة إلى فلك فرعي أعلى في الطاقة.
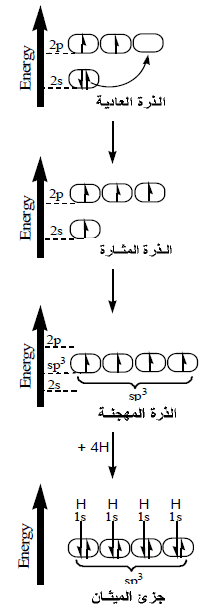
التهجين في جزئ الميثان CH4 – Methane
(1) من التوزيع الإلكتروني لذرة الكربون نجد أنها تحتوى على مزدوج إلكتروني في الفلك الفرعي (2s) وإلكترونين مفردين في الفلك الفرعي (2p).
(2) عند إثارة الذرة ينتقل إلكترون من الفلك الفرعي (2s) إلى الفلك الفرعي (2p) فتمتلك بذلك ذرة الكربون 4 أفلاك نصف ممتلئة ولكنها غير متماثلة في الشكل والطاقة.
(3) يحدث تهجين بين أفلاك (2s) وأفلاك (2p) في مستوى طاقة اعلى من مستوى طاقة الفلك (2s) وأقل من مستوى طاقة الفلك (2p) فتتكون 4 أفلاك متماثلة في الشكل والطاقة.
(4) تسمى الأفلاك المهجنة بأفلاك (sp3) لأنها نتجت من تهجين فلك (s) مع ثلاثة أفلاك (p)
(5) تتنافر الأفلاك المهجنة فيما بينها حتى تصل زوايا الربط (Bond angle) إلى 109.5o
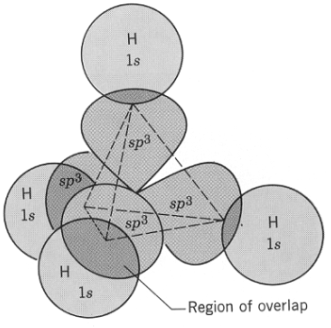
(6) يتم التداخل بين الأفلاك المهجنة وفلك (1S) لأربع ذرات هيدروجين فتتكون 4 روابط تساهمية أحادية من النوع سيجما (Sigma bond) وبذلك يتكون جزئ الميثان.
(7) عدد الروابط المتكونة في جزي الميثان أربعة روابط كلها من النوع سيجما.
(8) من خلال دراسة تهجين جزئ الميثان نستنتج أن الشكل الهندسي له هو هرم رباعي الأوجه tetrahedral كما يلي:
ملاحظات هامة
(أ) الرابطة سيجما : (σ) (Sigma bond) هي رابطة تنشأ من التداخل الأفقي للأفلاك أي تكونت على خط واحد
(ب) لا ترتبط ذرات الهيدروجين مع ذرة الكربون المثارة لأن الأفلاك تكون متعامدة بزوايا 90o وكذلك وجود نوعين من الأفلاك المختلفة في الشكل والطاقة (s, p).
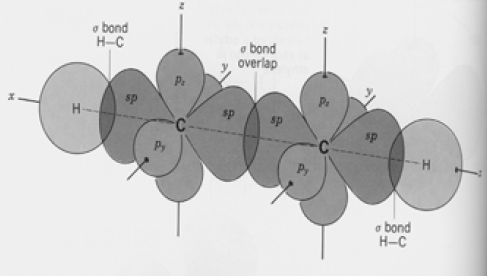
التهجين في جزئ الإيثيلين CH2 = CH2
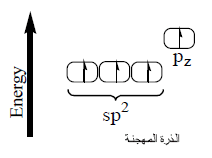
(2) يحدث تنافر بين الأفلاك المهجنة حتى تصل الزوايا بينها إلى 120o
(3) التداخل في جزئ الإيثلين:
(أ) تداخل يؤدي إلى تكوين روابط سيجما (σ):
– تداخل أفلاك (sp2) من كل ذرة كربون مع أفلاك (1s) من كل ذرة هيدروجين ينتج عنه رابطة C-H
– تداخل بين أفلاك (sp2) من كل ذرة كربون ينتج عنه رابطة C-C
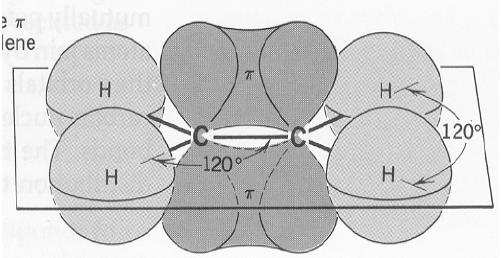
(ب) تداخل يؤدي إلى تكوين روابط باي (π):
نتيجة تداخل جانبي بين الفلك (pz) من ذرة كربون مع الفلك(pz) من ذرة الكربون الاخرى.
(4) عدد الروابط المتكونة في جزي الإيثلين = 6 روابط منها (5) روابط سيجما ورابطة واحدة فقط من النوع باي.
(5) من خلال دراسة تهجين جزئ الإيثلين نستنتج أن الشكل الهندسي له هو مثلث مسطح Planar triangle
ملاحظات هامة
(أ) الرابطة باي : (π) (Pi bond) هي رابطة تنشأ من التداخل الجانبي للأفلاك الذرية غير المهجنة أي تكون متوازية.
(ب) ان درجة تداخل الأفلاك الإلكترونية في رابطة سيجما (σ) أعلى من درجة التداخل في الرابطة باي (π) لهذا فأن الرابطة سيجما (σ) أقوى من الرابطة باي (π).
التهجين في جزئ الأسيتيلين CH ≡ CH Acetylene
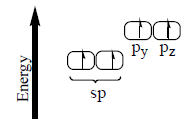
(2) تسمى الأفلاك المهجنة sp لأنها تكونت من تهجين فلك s)) وفلك (p).
(3) يحدث تنافر بين الأفلاك المهجنة حتى تصل الزوايا بينها إلى 180o
(4) التداخل في جزئ الأسيتيلين:
(أ) تداخل يؤدي إلى تكوين روابط سيجما (σ):
– تداخل أفلاك (sp) من كل ذرة كربون مع أفلاك (1s) من كل ذرة هيدروجين ينتج عنه رابطة C-H
– تداخل بين أفلاك (sp) من كل ذرة كربون ينتج عنه رابطة C-C
(ب) تداخل يؤدي إلى تكوين روابط باي (π):
نتيجة تداخل جانبي بين فلكي الفلك (py), (pz) من كل ذرة كربون فتتكون الرابطة الثلاثية CH ≡ CH
(5) عدد الروابط المتكونة في جزي الأسيتيلين = 6 روابط منها (3) روابط سيجما ورابطتين من النوع باي.
(6) من خلال دراسة تهجين جزئ الأسيتيلين نستنتج أن الشكل الهندسي له هو خطي Linear
مقارنة أطوال الروابط في جزيئات كل من الميثان والإيثان والإيثين والإيثاين
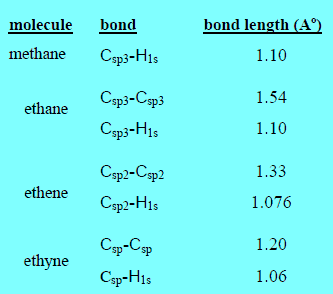
– من القيم المدرجة بالجدول نجد أن:
(1) الرابطة C-C الاحادية أطول من الرابطة C=C الزوجية والرابطة الزوجية أطول من الرابطة C ≡ C الثلاثية بسبب الكثافة الإلكترونية بين نواتي الكربون والتي تزداد بزيادة رتبة الرابطة.
(2) تتناقص الرابطة C-H في الطول مع زيادة رتبة الرابطة C-C وذلك بسبب ارتفاع نسبة طبيعة الفلك (s) في تهجين sp(50%)عن تهجين sp2(33%) وعن تهجين sp3(25%)حيث تميل إلكترونات فلك (s)للقرب من النواة.
– الجدول التالي يوضح مقارنة بين أطوال روابط C-C الأحادية وتأثرها بالتهجين:

نلاحظ من الجدول التناقص المنتظم في طول الرابطة C-C الأحادية نتيجة ارتفاع نسبة طبيعة الفلك (s)
التهجين في جزئ النشادر Ammonia – NH3
– يتم تهجين فلك (2s) مع افلاك (2p)لتكوين 4 أفلاك مهجنة من النوع (sp3)ثلاثة منها نصف ممتلئة ترتبط مع أفلاك (1s) لثلاث ذرات هيدروجين.
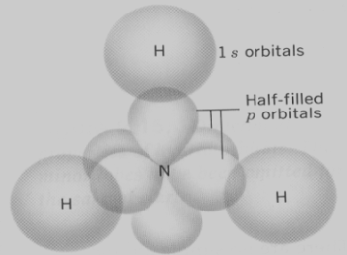
– تكون الزوايا بين أفلاك الأمونيا المهجنة 107o
– الشكل الهندسي لجزئ الأمونيا هو هرم رباعي الأوجه حيث يشغل زوج الإلكترونات غير الرابط رأس الهرم
الرباعي أي يكون له نفس شكل جزئ الميثان.
– لوصف الشكل الخاص لجزئ الأمونيا يهمل زوج الإلكترونات غير الرابط فيكون شكل الجزيء هو مثلث هرمي Trigonal pyramidal
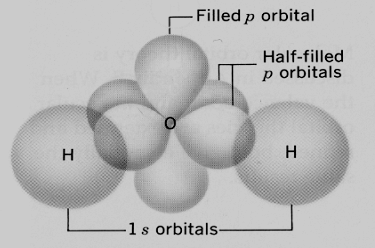
التهجين في جزئ الماء Water – H2O
– يتم تهجين فلك (1s) مع افلاك (2p)لتكوين 4أفلاك مهجنة من النوع (sp3)ثم تتنافر لتصل الزوايا بينها إلى 105o تقريباً.
– يتم التداخل بين فلكي (sp3)نصف الممتلئة مع فلك (1s) لرتي هيدروجين فيتكون جزئ الماء ويبقى زوجي الإلكترونات في الأفلاك غير الرابطة على ذرة الأكسجين.
– الشكل الهندسي لجزئ الأمونيا هو هرم رباعي الأوجه حيث يشغل كل زوج إلكترونات غير رابط أحد رؤوس الهرم الرباعي .
– لوصف الشكل الخاص لجزئ الماء يهمل زوجي الإلكترونات غير الرابط على ذرة الأكسجين فيكون شكل الجزيء هو الشكل الزاوي Angular
تاسعاً/ أنواع التهجين السائدة في الكيمياء العضوية
– يمكن إيجاد التهجين مباشرة من الجدول التالي الذي يوضح بعض أنواع التهجين السائدة في الكيمياء العضوية كما يلي:
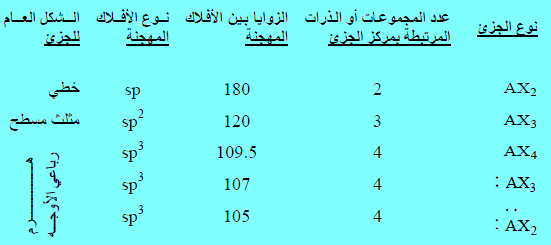
A: مركز الجزئ (الذرة المركزية)
X: عدد المجموعات أو الذرات المرتبطة تساهميا بالذرة المركزية ( أو الذرة المراد إيجاد التهجين لها ) .
– لاحظ أن عدد المجموعات أو الذرات المرتبطة بالذرة المراد إيجاد التهجين لها يساوي عدد الأفلاك المهجنة.
أمثلة محلولة
الحل:
يكون الحل كما يلي:

المراجع : أسس الكيمياء العضوية / وائل غالب محمد – وليد محمد السعيطي / الطبعة الأولى (2008) / دار الكتب الوطنية – بنغازي – لبيبا






اتمنى ان يتم نشر كل ماهو جديد ومفيد عن علم الكيمياء ,أنا استاذة في الكيمياء الفيزيائية أتمنى الاستفادة من كل ماهو منش
ور عن علم الكيمياء
ان شاء الله سوف يتم ذلك وتشرفنا بك فى موقعنا
شكرا بارك الله فيكم علي مدار سنوات لم افهمها الان
نحن هنا لمساعدتك تشرفنا بك على موقعنا
شكرا لكم على كل مجهودات بارك الله فيكم
شكراااااااااااا
شكرا جزيلا على مجهودك الرائع و جزاك الله كل خير
انا اريد من حضرتك اسماء كتب عن التهجين من حيث أنشأه و تطوره و شكرا مرة ثانية
شكراا ع هذا التوضيح الاكثر من رائع….
شكرا على هذا التوضيح الاكثر من رائع…..
السلام عليكم اريد عن الكهروسالبيه و طريقه مليكان
و طريقه بولنك بسرعه
ممكن مصادر
جزاك الله كل خير على هذا المجهود الرائع
احسنتم
اريد تحميل هذة الموضوعات
هذة للقراءة فقط يا عزيزي … وهى موجودة دائماً بالموقع تحت أمرك
اريد ان اعرف التهجين ما بين ذرة البريليوم وذرتان كلور
بارك الله فيك يا استاذنا الجليل