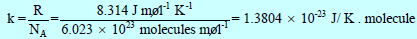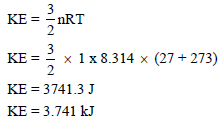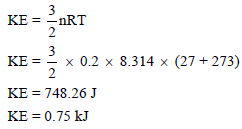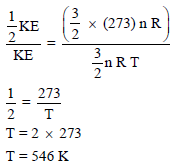الطاقة الحركية ودرجة الحرارة Kinetic Energy and Temperature
حيث أن:
N: عدد جزيئات الغاز
m: كتلة الجزئ في حيز ما
ˉu2: متوسط مربع سرعة الجزئ الواحد.
– من خلال المعادلة الأساسية للنظرية الحركية للغازات والقانون العام للغازات يمكن استنتاج العلاقة بين الطاقة الحركية ودرجة الحرارة كما يلي:
– بالتالي فإنه لحساب الطاقة الحركیة لعدد n من المولات فإن:
ومنه فإن الطاقة الحركیة لكمیة محددة من الغاز لا تعتمد على ضغطه ، ولا حجمه ولا نوعه بل تعتمد فقط على درجة حرارته.
– إذا اخترنا القيمة (8.314 JK-1mol-1) قيمة ثابت الغاز R ، فإن إسهام الحركة الانتقالية في طاقة جزئ جرامي واحد من أي غاز مثالي عند درجة حرارة 25 Co تصبح:
– يمكن التعبير عن متوسط طاقة الحركة لجزيء واحد من غاز كما یلي:
ثابت بولتزمان Boltzman’s Constant
– ونظراً لأن معظم دراستنا اللاحقة تتعلق بطاقات الجزیئات والذرات المنفردة فمن الأفضل أن ندخل ثابتاً جدیداً یعرف بثابت بولتزمان Boltzman’s Constant ویرمز له بالرمز (k) وتكون قیمته كما یلي:

– ثابت بولتزمان ھو ثابت الغاز للجزيء الواحد، وبذلك تكون متوسط طاقة الحركة للجزيء الواحد تساوي:
– ويكون متوسط طاقة الحركة لجزئ ما عند درجة حرارة (25 Co) مساوية:
طريقة إثبات أخرى للعلاقة بين الطاقة الحركية ودرجة الحرارة
من المعادلة نجد أن: درجة الحرارة تتناسب تناسباً طردياً مع متوسط طاقة الحركة الجزيئية.
– متوسط الطاقة الحركية لعدد (n) من مولات الغازات:
– متوسط الطاقة الحركية لجزئ من الغاز:
أمثلة محلولة على العلاقة بين الطاقة الحركية ودرجة الحرارة
مثال (1): ما مقدار طاقة الحركة عند الظروف القياسية لكل من:
(أ) 0.1 mol من غاز ما
(ب) 1 mol من غاز ما
الحل:
نتبع العلاقة التالية :

مثال (2): أوجد طاقة حركة مول واحد من غاز مثالي عند (27 Co) بوحدة KJ
الحل:

مثال (3): أوجد طاقة حركة (0.2 mol) من غاز مثالي عند (27 Co) بوحدة KJ
الحل:

مثال (4): أوجد الطاقة الحركية لكتلة مقدارها (14 g) من غاز (CO) عند (25 Co) بوحدة الجول (J) (الكتلة الذرية: C=12 , O = 16)
الحل:
نوجد أولاً عدد المولات كما یلي :
ثم نوجد الطاقة الحركیة كما یلي :

مثال (5): أوجد درجة الحرارة بوحدة الكلفن (K)لكي تكون للطاقة الحركية لمول من غاز الأكسجين نصف قيمتها عند الظروف القياسية.
الحل:
نكون معادلتين إحداهما في درجة حرارة (T) والأخرى في درجة حرارة 298 K (الحرارة في الظروف القياسية).
وبقسمة المعادلة (2) على المعادلة (1) نحصل علي:

مثال (6): أحسب ضغط (4 g) من غاز النيتروجين (N2) إذا علمت أن حجمه يساوي ( 250 ml) وأن الطاقة الحركية (KE) لمول واحد منه تساوي 12471 J/mol
الحل:
أولاً: من قانون الطاقة الحركیة نوجد درجة الحرارة
وبالتطبيق في قانون الغازات العام لنحسب الضغط:
المراجع
– أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية

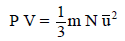
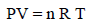
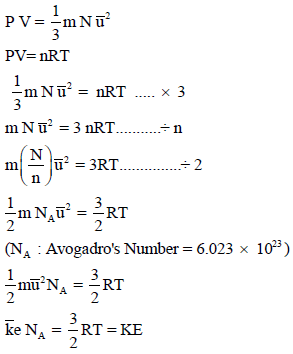
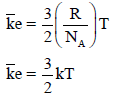
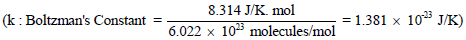
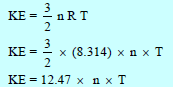
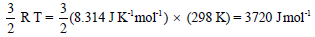
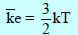
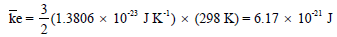
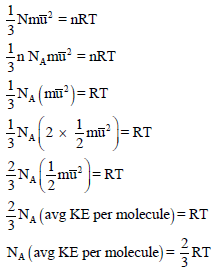
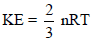
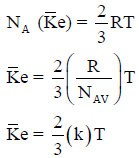
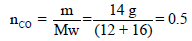
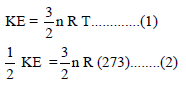
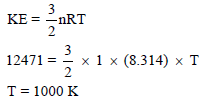
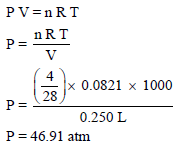
 تعرف على علم الكيمياء
تعرف على علم الكيمياء