
معايرات الترسيب Precipitation Titrations
– معايرات الترسيب: يتم في هذا النوع من المعايرة تفاعل بين المادة المراد تعيينها وبين المحلول القياسي الذي عادة ما يضاف من السحاحة. يؤدي التفاعل بين هذين المحلولين إلى تكون راسب.
– تعتمد أهمية هذا النوع من المعايرة على ظروف الترسيب، فمثلاً يجب أن تكون ذوبانية الراسب قليلة جداً في المحلول أى أن يكون Ksp صغير جداً.
– يجب أن تكون عملية الترسيب سريعة وأن يعرف التركيب الكيميائي للراسب المتكون ليسهل بذلك تعيين تركيز المادة المراد تحليلها. ويجب أن يكون هناك طريقة لتعيين نقطة النهاية (end-point).
– من أهم التطبيقات على معايرات الترسيب هي معايرة الهاليدات وتتضمن معايرة الكلوريد والبروميد والأيوديد ، وكذلك معايرة السيانيد والثيوسيانيد، حيث تستخدم نترات الفضة في المعايرة، كما أن أيون الكبريتات يمكن تعيينة باستخدام محلول الباريوم .
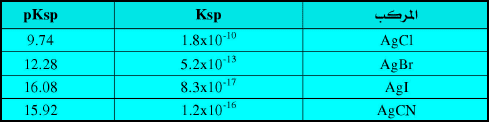
– الجدول التالي يوضح قيم Ksp لبعض الرواسب المعروفة:
منحنيات معايرات الترسيب
– إن إنشاء هذا النوع من المنحنيات يُعد ضرورياً لمعايرات الترسيب ، إذ من التغير الذي يحدث عند نقطة النهاية (end point) نستطيع الحكم على إمكان إجراء هذا النوع من المعايرة. وكذلك نستطيع اختيار الدليل المناسب الذي يحدث التغير المناسب في اللون، والذي بواسطته نعرف نقطة النهاية بشكل دقيق.
– يمكن الحصول على البيانات اللازمة لعمل منحنى المعايرة من ثابت الذوبانية Ksp وتركيز المادة المتفاعلة بعد كل إضافة.
– لتوضيح هذا النوع من الحسابات نأخذ ترسيب أيون البروميد كمثال ، حيث يكون التفاعل بعد إضافة نترات الفضة إلى محلول البروميد كالتالي:
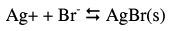
هذا التفاعل هو معاكس لتحلل بروميد الفضة، ونستطيع أن نعين ثابت الاتزان من العلاقة التالية:
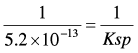
وبما أن قيمة الناتج كبيرة فإن التفاعل يكون مكتملاً (Complete reaction) أي أن أيونات الفضة التي تضاف قبل الوصول إلى نقطة النهاية تتفاعل كلياً وتتحول إلى بروميد الفضة.
وعلى هذا الأساس نستطيع تقسيم تفاعل الترسيب بين نترات الفضة وبروميد الصوديوم إلى ثلاث أجزاء:
(1) قبل نقطة النهاية Before the end point
– تكون المركبات الموجودة كما يلي:
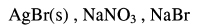
– حيث إن التفاعل معروف النسب ، فإن:
كمية NaBr المتبقي بعد كل إضافة = كمية NaBr الأصلية – كمية Ag NO3 المضافة.
– يمكن تعيين تركيز بروميد الصوديوم المتبقي بقسمة عدد المللي مولات المتبقية على الحجم الجديد.
– وفي الحقيقة هناك مصدران لبروميد الصوديوم هما الكمية المتبقية بعد التفاعل والكمية الناتجة من تفكك بروميد الفضة المتكون.
حيث أن ثابت الإذابة Ksp لبروميد الفضة قليل جداً فيمكن إهمال كمية البروميد الناتجة لهذا:
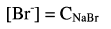
وأيون الفضة يتكون من التفكك البسيط للراسب.
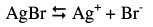
يمكن تعيين تركيز أيون الفضة من حالة الاتزان.
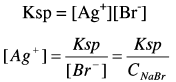
(2) عند نقطة النهاية At the end point
وهنا يكون المصدر الوحيد لأيون البروميد هو الراسب AgBr وذلك وفق ثابت الإذابة Ksp
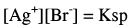
وحيث أن:
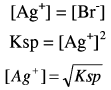
(3) بعد نقطة النهاية After the end point
– يكون هنا زيادة في كمية نترات الفضة المضافة، وهذه هي مصدر أيونات الفضة.
– كمية نترات الفضة الزائدة = كمية نترات الفضة المضافة – كمية نترات الفضة المستهلكة.
وحيث أن كمية نترات الفضة المستهلكة = كمية بروميد الصوديوم الأساسية.
أذن كمية نترات الفضة المتبقية = كمية بروميد الصوديوم – كمية نترات الفضة المضافة
– نستطيع حساب تركيز أيون الفضة Ag+ مساوياً لعدد ملي مولات نترات الفضة المتبقية مقسومة على الحجم الكلي للمحلول.
ملاحظة هامة
في حالات التفاعلات الأخرى تجب مراعاة عدد المولات لكل متفاعل. ففي هذا المثال تكون النسبة 1:1 أي أن 1 مول من Ag+ يتفاعل مع 1مول من Br– بينما في حالة Ag2CrO4 كل 1 مول من كرومات يتفاعل مع 2 مول من Ag+ فتراعى هذه النسبة.
أمثلة توضيحية لرسم منحنى معايرات الترسيب
مثال (1): معايرة 25 مل من بروميد البوتاسيوم 0.1 M KBr بنترات الفضة ذات التركيز AgNO30.2 M احسب pAg بعد إضافة 5 مل ، 12.5 مل ، 15 مل من نترات الفضة؟
التفاعل:
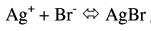
(1) بعد إضافة 5 مل من نترات الفضة (قبل نقطة النهاية) :
عدد مولات KBr الأصلية = 0.1 × 25 = 2.5 مل مول
وعدد مولات Ag+ المضافة = 0.2 × 5 = 1 مل مول
عدد مولات KBr المتبقية = 1 – 2.5 = 1.5 مل مول
تركيز Br– المتبقي = 1.5 / (5+25) = 0.05 مولار
يأتي أيون الفضة من تفكك AgBr وحسب تعبير ثابت الإذابة Ksp
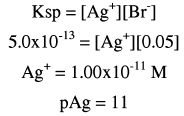
(2) بعد إضافة 12.5 مل من نترات الفضة(عند نقطة النهاية):
عدد مولات KBr الأصلية = 0.1× 25 = 2.5 مل مول
عدد مولات Ag+ المضافة = 0.2 × 12.5 = 2.5 مل مول
وحيث أن هذه تمثل نقطة النهاية فإن المصدر الوحيد لأيونات الفضة هو تفكك AgBr حسب Ksp
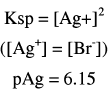
(3)بعد إضافة 15 مل من نترات الفضة(بعد نقطة النهاية):
عدد مولات KBr الأصلية = 0.1 × 25 = 2.5 مل مول
وعدد مولات Ag+ المضافة = 0.2 × 15 = 3 مل مول
عدد مولات AgNO3 المتبقية = 2.5 – 3 = 0.5 مل مول
وحيث أن المصدر المهم لأيونات الفضة هو الكمية المتبقية من AgNO3 لذا فإن:
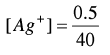
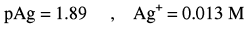
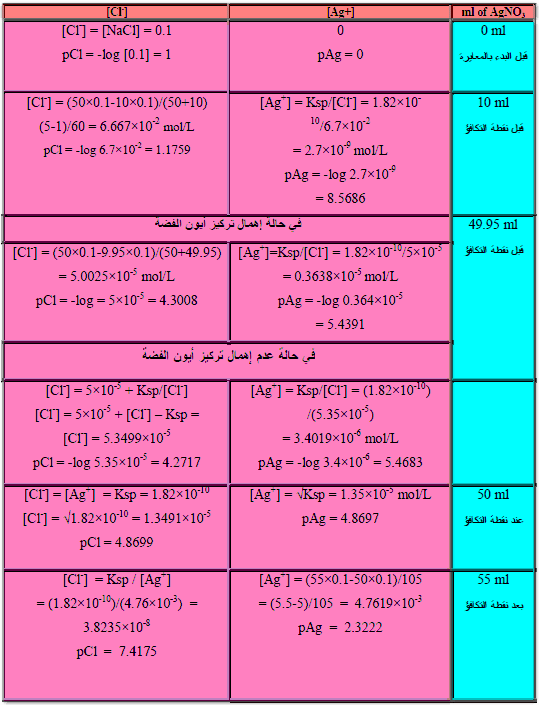
مثال (2): معايرة 50 مل من كلوريد الصوديوم 0.1 N NaCl بنترات الفضة ذات التركيز AgNO30.1 N
احسب pAg بعد إضافة 0 مل ، 10 مل ، 49.95 مل ، 50 مل ، 55 مل من نترات الفضة؟
العوامل المؤثرة على شكل منحنى معايرات الترسيب
(١) تركيز المحلول (تركيز المواد الداخلة في التفاعل):
كلما زاد تركيز المواد المتفاعلة كلما تم تقدير نقطة التكافؤ بوضوح وكلما قل الخطأ الناتج عن الدليل المستخدم.
(٢) إكتمال التفاعل:
وهذا يعتمد على قيمة حاصل الإذابة للرواسب المتكونة فكلما قلة قيمة حاصل الإذابة كلما كان التفاعل يسير إلى النهاية. وكلما أمكن تحديد نقطة التكافؤ.
المراجع:
– كتاب الكيمياء التحليلية (المفاهيم الأساسية في التحليل التقليدي والآلي) / عبد الله محمود أبو الكباش / قسم الكيمياء جامعة الملك فهد للبترول والمعادن/ الرياض / الطبعة الأولى 2012م
– محاضرات الكيمياء التحليلية (التحليل الحجمى والوزني) / خيرية محمد عبدالله الأحمري /(1430 – 1429 هـ ) / جامعة الملك عبد العزيز- المملكة العربية السعودية.







قوه القوه…لكن ياريت يكون شرح بالانجليزية