
(1) تعريف الكيمياء الكهربية Definition of Electrochemistry
– الكيمياء الكهربية هي ذلك الفرع من الكيمياء الفيزيائية الذي يهتم بدراسة التحولات الكيميائية الناتجة عن مرور التيار الكهربائي، وكذا إنتاج الكهرباء عن طريق التحولات الكيميائية.
– إذا عملت الترتيبات أثناء حدوث تفاعل أكسدة- اختزال بحيث يمكن إمرار الإلكترونات التي تنتقل في تفاعل تلقائي من هذا النوع خلال موصل فلزي فإنه يمكن استخدام هذا التفاعل كمصدر للطاقة الكهربية ويمكن حدوث ذلك إذا منعت المواد المتفاعلة من الاتصال المباشر ، وفي حالة اتصالها المباشر فإن الطاقة تنطلق على هيئة طاقة حرارية بدلاً من الطاقة الكهربائية.
– مجالات الاستفادة من الكيمياء الكهربية لا حصر لها ابتداءاً من ألعاب الأطفال وحتى المركبات الفضائية.
(2) اكتشاف الكيمياء الكهربية Discovery of Electrochemistry
– في القرن الثامن عشر الميلادي وجد العالم الإيطالي جالفاني Galvani (1737-1798م) ، وهو متخصص في مجال التشريح، أن انتفاضة لاإرادية تنتاب ضفدعاً حينما يتماس سلكان معدنيان موصولان بفخذيه.
– هذه كانت واحدة من أشهر التجارب التي نمت وتطورت حتى صارت فرعاً من الفروع الهامة في الكيمياء الكهربية.
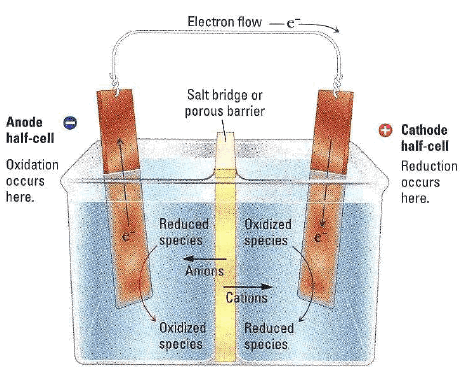
(3) الخلايا الكهروكيميائية Electrochemical Cells
– الخلايا الكهروكيميائية هو عبارة عن جهاز يُستخدم لتوليد التيار والقدرة الكهربائية عن طريق التفاعلات الكيميائية والتي يحدث من خلالها انتقال للالكترونات بين قطبي هذه الخلية.
– بكل ببساطة، فإن الخلية الكهروكيميائية عبارة عن قطبين موصولين ببعض ومكونين لدائرة كهربائية.
– الخلايا الكهروكيميائية تستخدم لغرضين هما:
(أ) تحويل الطاقة الكيميائية إلى طاقة كهربائية:
وذلك نتيجة لبعض التغيرات أو التفاعلات الكيميائية (خلايا جلفانية). ومن الأمثلة على هذا النوع من الخلايا، الخلايا الجافة (خلايا لي كلانشيه) والتي يتم فيها تحويل الطاقة الكيميائية إلى طاقة كهربائية.
(ب) تحويل الطاقة الكهربائية إلى طاقة كيميائية:
وفيها يتم الحصول على تفاعلات كيميائية نتيجة مرور تيار كهربائي في محلول، وتسمى بعملية التحليل الكهربائي (خلايا التحليل الكهربائي).
ومثال ذلك البطاريات أثناء شحنها وفيها يتم تحويل الطاقة الكهربائية إلى طاقة كيميائية.
ومثال ذلك البطاريات أثناء شحنها وفيها يتم تحويل الطاقة الكهربائية إلى طاقة كيميائية.
(4) ما الفرق بين الخلية والبطارية؟
الخلية Cell
الخلية عبارة عن قطبين مغمورين في محلول إلكتروليتي قادر على إعطاء تيار كهربائي نتيجة لتفاعل كيميائي يتم داخل الخلية.
البطارية Battery
البطارية عبارة عن سلسلة من خليتين أو أكثر . ومثال ذلك بطارية الرصاص (6 فولت) وهي البطارية المستخدمة في السيارات وهي عبارة عن سلسلة من خليتين كل منهما ذات جهد قدره (2 فولت).
(5) أهمية الكيمياء الكهربائية وتطبيقاتها
(1) الكيمياء الكهربائية تقدم تفسيراً لكثير من الظواهر مثل: تنقية المعادن ، وتآكل المعادن وتفاعلات الأيونات مع بعضها ومع المذيب في المحلول.
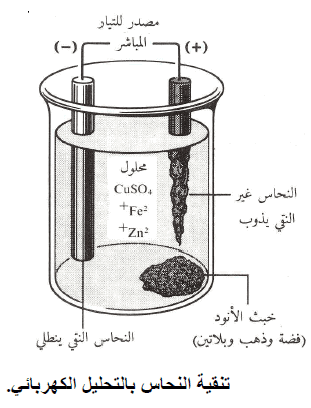
(2) للعمليات الإلكتروكيميائية أهمية عملية في الكيمياء وفي الحياة اليومية فالخلايا الإلكتروليتية تمدنا بمعلومات حول البيئة الكيميائية وكذلك عن الطاقة اللازمة لحدوث العديد من تفاعلات الأكسدة والاختزال المهمة.
(3) يستخدم التحليل الكهربائي لعمل العديد من المركبات الكيميائية الهامة التي لها استعمالاتها في حياتنا، ومن أمثلتها هيدروكسيد الصوديوم NaOH ، الذي يستعمل لعمل الصابون، الورق، والعديد من الكيميائيات الأخرى، والمبيض السائل NaOCl
(4) الخلايا الفولتية مثل الخلية الجافة تزود الأضواء الومضية، والراديوهات، والحاسبات الإلكترونية وآلات التصوير، وألعاب الأطفال، بالقوة اللازمة لتشغيلها. وقد حققت بطارية التخزين الرصاصية المعتادة تطبيقات واسعة الإنتشار، خصوصاً في السيارات.
(5) خلايا الوقود وفيها يتم الحصول على الطاقة من احتراق الوقود، ويتم تحويل هذه الطاقة مباشرة إلى كهرباء. ولهذه الخلايا استعمالات عديدة خصوصاً في سفن الفضاء.
(6) ساعدت المعرفة الإلكتروكيميائية العلماء في إنتاج الأجهزة الحديثة اللازمة لتحليل التلوث وإجراء الأبحاث الطبية الحيوية. وبمساعدة المجسات الإلكتروكيميائية الدقيقة بدأ العلماء في دراسة التفاعلات الكيمائية التي تحدث في الخلايا الحية.
(6) الوحدات الكهربائية Electric units
أمكن تطبيق أوم على محاليل الإليكروليتات ، وينص هذا القانون على أن: “شدة التيار (I) تتناسب تناسباً طردياً مع القوة الدافعة الكهربائية المستخدمة (E)، وعكسياً مع المقاومة (R) أي أن:
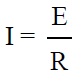
(I): شدة التيار بوحدة الأمبير (A)
(E): الجهد بوحدة الفولت (V)
(R): المقاومة بوحدة الأوم ((W
(7) أقسام التيار الكهربائي Types of Electric current
– التيار الكهربائي هو تدفق من الشحنات الكهربائية كالإلكترونات أو الأيونات. طبقًا للنظام الدولي للوحدات فإن شدة التيار الكهربي تقاس بـ الأمبير. بينما يقاس التيار الكهربي بجهاز الأميتر.
– هناك نوعان من تيار الكهرباء: التيار المستمر & التيار المتردد
(أ) التيار المتردد Alternating current (AC)
التيار المتردد هو التيار المستخدم في المنازل لكافة الأغراض من إنارة وتسخين وتشغيل للآلات – ويتولد من إدارة ملف من سلك النحاس في المجال المغناطيسي، وفيه تتردد الإلكترونات في اتجاهين متضادتين بسرعة.
(ب) التيار المستمر Direct current (DC)
يتولد التيار المستمر من مركم (بطارية) أو مقومات التيار المتردد وفيه تتحرك الإلكترونات في اتجاه واحد فقط.
(8) تقسيم المواد من حيث توصيلها للكهرباء
(1) الموصلات Electrical conductors
وهي تلك المواد التي تسمح بمرور التيار الكهربائي دون أن تحلل به وهي العناصر مثل الكربون والمعادن.
(2) المواد العازلة Dielectric materials
وهي تلك المواد التي لا تسمح بمرور التيار الكهربائي. وهي مركبات تحتوي على روابط تساهمية مثل المركبات العضوية كالسيليكات.
(3) أشباه الموصلات Semiconductor
وهي تلك المواد المتوسطة بين الموصلات والمواد العازلة.
(4) الإليكتروليتات Electrolyte
وهي مواد توصل التيار الكهربائي ولكنها تتحلل به، كما أنها تتأين عند ذوبانها في الماء.
(9) تفاعلات الأكسدة والاختزال Redox reactions
(أ) الأكسدة Oxidation
– الأكسدة هي العملية التي يحدث فيها فقد إلكترونات، أو هي التفاعل الذي يؤدي إلى جعل الأكسدة لذرة أو جزئ أو أيون أكثر إيجابية.
– مثال توضيحي لتفاعل الأكسدة:
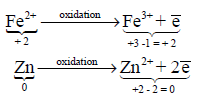
(ب) الاختزال Reduction
– الاختزال هو العملية التي يحدث فيها اكتساب للإلكترونات أو هو التفاعل الذي تصبح فيه الحالة التأكسدية لأيون أو ذرة أو جزئ أقل إيجابية.
– مثال توضيحي لتفاعل الاختزال:
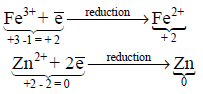
– يلاحظ من المثالين السابقين أن عملية الإختزال هي التفاعل العكسي لعملية الأكسدة
(10) مثال توضيحي لتفاعل أكسدة واختزال
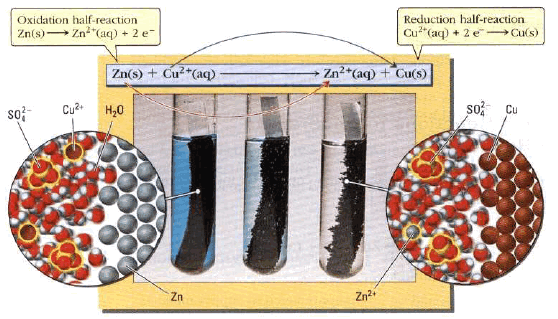
– عند غمر قطعة خارصين (Zn) في محلول كبريتات نحاس (CuSO4) يحدث تفاعل تلقائي يتم بموجبه:
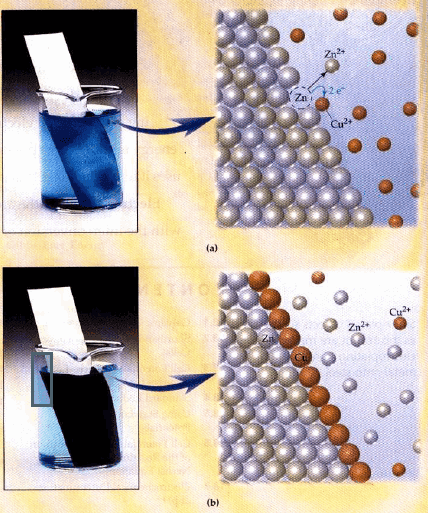
(أ) تذوب قطعة الخارصين تدريجياً (تتآكل وتتأكسد)
نصف تفاعل الأكسدة – التآكل:
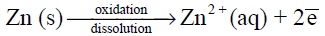
(ب) ترسيب النحاس (الذي يكون على هيئة أيونات في المحلول (Cu+2) على قطعة الخارصين)
نصف تفاعل الاختزال – الترسيب
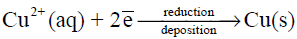
ويلاحظ أن لون محلول أيونات النحاس الأزرق بدأ يخف بسبب ترسب ايونات النحاس (اختزالها)
(جـ) يصاحب التفاعل انطلاق حرارة
– يمكن أن يكتب التفاعل الكلي لنصفي التفاعل السابقين (الأكسدة- الاختزال) على الصورة التالية:

أو تكتب مختصرة:
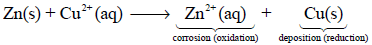
سؤال: بالنسبة للإلكترونات الناتجة عن عملية الأكسدة هل تتدفق في هذه الحالة ( أي في حالة غمر قطب الخارصين في محلول كبريتات النحاس)؟
الجواب:
لا يحدث أي تدفق للإلكترونات نظراً لتلامس ذرات الخارصين (Zn(s)) وأيونات النحاس (Cu2+(aq)) لذلك تفقد الطاقة الكهربائية على هيئة حرارة.
لا يحدث أي تدفق للإلكترونات نظراً لتلامس ذرات الخارصين (Zn(s)) وأيونات النحاس (Cu2+(aq)) لذلك تفقد الطاقة الكهربائية على هيئة حرارة.
– يمكن الاستفادة من التفاعل:
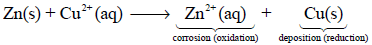
كمصدر للتيار الكهربائي بتصميم خلية(Cell) يتم من خلالها التفاعل، ويمكن للالكترونات أن تتدفق عبر وسيلة اتصال خارجية. وكان أول من صمم خلية للاستفادة من التيار الكهربائي الناتج من هذا التفاعل هو العالم دانيال.
(11) مصطلحات هامة متعلقة بالكيمياء الكهربائية
(1) الأكســــدة Oxidation
الأكسدة ھي فقد العنصر إلكتروناً أو أكثر أو ھي الزيادة في عدد الأكسدة.
(2) الاختــزال Reduction
الاختزال ھو اكتساب العنصر إلكترونا أو أكثر أو ھو النقص في عدد الأكسدة.
(3) العامل المؤكسد Oxidizing agent
ھو المادة التي تؤكسد مادة أخرى تتفاعل معھا ، وتحدث لھا عملية اختزال (تكتسب إلكترونا أو أكثر).
(4) العامل المختزل Reducing agent
ھو المادة التي تختزل مادة أخرى تتفاعل معھا ، وتحدث لھا عملية أكسدة (تفقد إلكترونا أو أكثر).
(5) عدد الأكسدة Oxidation Number
ھو عدد الإلكترونات التي يمكن أن تفقدها أو تكتسبها أو تساھم بھا ذرة العنصر خلال التفاعل.
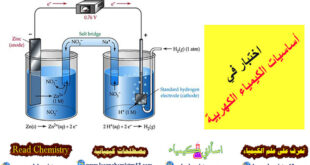
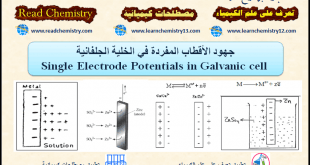
(6) المصعد Anode
– ھو القطب الذي يحدث له أكسدة (تآكل) إن كان نشطا مثل الخارصين ،النحاس ، الكادميوم.
– ھو القطب الذي تحدث على سطحه أكسدة الأصناف الموجودة في المحلول أن كان خاملاً.
– ومن أمثلة الأقطاب الخاملة البلاتين Pt ، الذهب Au
– ھو القطب الذي تحدث على سطحه أكسدة الأصناف الموجودة في المحلول أن كان خاملاً.
– ومن أمثلة الأقطاب الخاملة البلاتين Pt ، الذهب Au
– ومن أمثلة الأصناف في المحلول التي يمكنھا أن تتأكسد:
1- الأيونات السالبة مثل I– ، Cl–
2- جزئيات الماء H2O
– وفى الغالب فأن أقطاب المصعد النشطة تستخدم في الخلايا الجلفانية بينما أقطاب المصعد الخاملة تستخدم فى خلايا التحليل الكهربي.
(7) المهبط Cathode
هو القطب الذي يحث على سطحه الاختزال ويكون دوره فقط هو التوصيل الكهربائي.
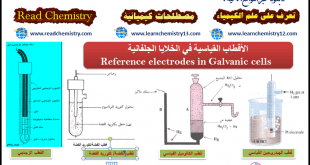
(8) القنطرة الملحية Salt bridge
أنبوبة زجاجية أو بلاستيكية مفتوحة الطرفين على شكل حرف (U) تملأ بمحلول مشبع من ملح كلوريد البوتاسيوم (KCl) ، أو كبريتات البوتاسيومK2SO4)) أو غيرھا، وبعد ملئھا ينبغي التأكد أنه لا توجد فقاعات ھهوائية داخل المحلول الذي بھا، فإن وجد يسكب محتواھا ويعاد ملؤھا من جديد وبعد ملئھا بالمحلول تسد فتحتاھا بسدادة من قطن أو مناديل ورقية ثم تنكس ويوضع كل طرف منھا في محلول من محاليل الخلية الجلفانية.
المراجع – كتاب الكيمياء الكهربائية / د.عمر بن عبدالله الهزازي/ قسم الكيمياء-كلية العلوم التطبيقية – جامعة أم القرى/ المملكة العربية السعودية
 تعرف على علم الكيمياء
تعرف على علم الكيمياء



بارك الله فيكم وجزاكم كل خير