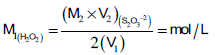تجربة تقدير كمیة فوق أكسید الهیدروجین في عینة تجاریة
اسم التجربة: تعیین كمیة فوق أكسید الهیدروجین (H2O2) في عینة تجاریة.
الهدف من تجربة تقدير كمیة فوق أكسید الهیدروجین
– تقدیر مولاریة فوق أكسید الهیدروجین (H2O2) وحساب التركیز بالوحدات المختلفة وذلك عند معایرتها بواسطة المعایرات الیودیدیة باستخدام محلول 10% من محلول یودید البوتاسیوم الذي یعمل على تحریر اليود (I2) المستخدم في المعایرة.
– معادلة التفاعل:
H2O2 + 2I– + 2H+ → I2 + 2H2O
– یتفاعل فوق أكسید الهیدروجین مع أنیون الیودید في وسط حمضي طبقاً للمعادلة السابقة ولكن هذا التفاعل بطيء نسبیاً ولكن تزداد سرعته بزیادة تركیز الحمض.
– ولكن یمكن أن یصبح هذا التفاعل لحظیاً وذلك عند إضافة 3 قطرات من محلول مولبيدات الألومنيوم (NH4)2 Mo4تركيز 20%
– محلول مولبیدات الأمونیوم یساعد على أكسدة حمض الهیدرویودیك (HI) بأكسجین الهواء الجوي مما یضطر لإجراء المعایرة في هذه الحالة في جو خامل من ثاني أكسید الكربون (CO2) أو غاز النيتروجين (N2).
– تتمیز الطرق الیودیدیة عن البرمنجانات البوتاسیوم بأنها لا تتأثر إلى حد ما بالمواد التي تسبب استقرار فوق أكسید الهیدروجین (وهي المواد التي تضاف إلى التحضیرات التجاریة والمواد الحافظة) مثل حمض البوریك (HBO3) وحمض السلسلیك والجلیسرول مما یجعل المعایرة بالبرمنجانات قلیلة الدقة وكثیر الأخطاء.
المواد الكيميائية المستخدمة في تجربة تعيين تركيز فوق أكسید الهیدروجین
- محلول فوق أكسید الهیدروجین التجاري.
- محلـول 10% من يوديد البوتاسيوم ، ويحضر بإذابة 10 جم من ملح يوديد البوتاسيوم في 100 مل مقطر.
- محلول حمض الكبریتیك (2N)
- محلول ثیوكبریتات الصودیوم القیاسي (0.05M)
- الدلیل (محلول النشا)
- محلول مولبيدات الألومنيوم (NH4)2 Mo4 تركيز 3%
الأدوات المستخدمة
- قطارة
- سحاحة وحامل السحاحة
- ماصة قیاسیة
- دورق مخروطي400 مل
- كأس زجاجية سعة 400مل
- ساق زجاجية
خطوات تجربة تركيز فوق أكسید الهیدروجین
(1) خذ 25 مل بالماصة من محلول فوق أكسید الهیدروجین التجاري المخفف بأخذ 15 مل من المحلول الأصلي في 250 مل ماء مقطر في دورق المعایرة.
(2) أضف إلى الدورق المخروطي10 مل من حمض الكبریتیك (2N) ورج الدورق جيداً.
(3) أضف إلى الدورق المخروطي 10مل من محلول یودید البوتاسیوم10 % ورج المحلول جیداً.
(4) اترك المحلول لفترة 15 دقیقة وهو مغطى، ویمكن بدلاً من الانتظار لمدة 15 دقیقة. ویمكن إضافة 3 قطرات من محلول مولبیدات الأمونیوم (3%)
في هذه الحالة لا یتم الانتظار بل تتم المعایرة مباشرة ویمكن الحصول على نتائج أفضل عند إضافة بعض مكعبات صغیرة من الثلج الجاف قبل إضافة مولبیدات الأمونیوم.
(5) أملأ السحاحة بمحلول ثیوكبریتات الصودیوم القیاسیة (0.05M) بعد تنظیفها جیداً بالماء المقطر.
(6) أبدء عملية المعایرة للیود المتحرر بمحلول الثیوكبریتات القیاسي وعندما یخف لون الیود أضف 5 مل من محلول النشا وأكمل المعایرة إلى أن یتحول لون المحلول من الأزرق إلى عدیم اللون (الشفاف) ، وسجل الحجم المستهلك من السحاحة.
(7) كرر التجربة مرتين ودون النتائج في جدول وخذ متوسط الحجم.
الحسابات
(1) حساب المولارية Morality
– من معادلة تفاعل فوق أكسيد الهيدروجين مع أيون اليوديد نجد أنه يحرر مول واحد من اليود
H2O2 + 2I– + 2H+ → I2 + 2H2O
I2 + 2S2O3-2 → 2I– + S4O6-2
– من معادلات التفاعل السابقة نجد أن:
– عدد مللي مولات فوق أكسيد الهيدروجين = عدد مللي مولات ثيوكبريتات الصوديوم
M1 × V1 = M2 × V2 (Na2S2O3) (H2O2)
– لكي يتم تكافؤ عدد مللي مولات سيتم ضرب مللي مولات فوق أكسيد الهيدروجين × 2 ، وضرب مللى مولات الثيوكبريتات × 1 ويكون:
2 (M1 × V1) = 1 (M2 × V2) (Na2S2O3) (H2O2)
:بالتالي فإن المولارية تعين من العلاقة كما يلي
(2) حساب التركيز بالميكرومول/مل
تحسب من العلاقة الآتية كما يلي:
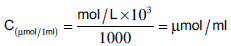
(3) حساب التركيز بالملي جرام/5 مل
تحسب من العلاقة الاتية كما يلي:
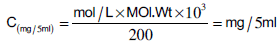
تعليمات السلامة داخل المختبر الكيميائي
يجب عليك قبل بدء التجربة مراعاة الآتي:
(1) يجب مراعاة نظافة المختبر والأدوات المستخدمة به.
(2) يجب عدم إلقاء المواد الكيماوية بالأحواض إلا بعد تخفيفها ، كما لا يجوز نهائيا إلقاء قطع أو قشور الصوديوم في الأحواض.
(3) يجب أن تكون الأرضيات وكذلك أسطح الطاولات من مواد مقاومة للحريق والمواد الكيماوية وسهلة التنظيف.
(4) يجب غسل الأواني التي بها بقايا مواد سريعة الاشتعال بعد انتهاء العمل بها.
(5) يجب عدم تخزين الكيماويات أو عينات المواد المراد حفظها داخل المختبر إلا بأقل قدر ممكن ولحاجة العمل فقط.
(6) يجب عدم حفظ السوائل السريعة التبخر إلا في الثلاجات، كما يجب الانتباه عند تغطية زجاجات الكيماويات.
(7) يجب وضع إناء مملوء بالرمل تحت القناني التي لا يوجد سبيل آخر لحمايتها ، واعلم أن استخدام الرمال والتراب لامتصاص الأحماض المنسكبة على الأرض من الوسائل الآمنة من وجهة نظر السلامة.
(8)عند تسخين مواد سريعة الاشتعال يجب استخدام حمام مائي .
تعليمات أخري
(9) لا تحاول أن تدخل بقوة أنبوبة في سدادة فلين أو مطاط ، بلل الزجاج بالماء أو الزيت أولاً لأن ذلك يسهل ألي حد كبير هذه العملية.
(10) يجب تداول المواد الخطرة حسب الأسس العلمية ، وكمثال عند تخفيف حمض الكبريتيك فأن الحمض يضاف للماء ولا يضاف الماء إليه .
(11) يجب عدم استخدام المواد الخطرة كالفوسفور إلا تحت الإشراف الفعلي لمسئول المختبر. كما يجب مراعاة حفظ الفوسفور الأبيض والأصفر تحت سطح الماء لمنع اشتعالها تلقائيا حيث إنها تشتعل بمجرد تعرضها للهواء.
(12) يجب أن يكون بكل مختبر أكثر من مخرج وكما يفضل أن تكون الأبواب من النوع المفصلي التي تفتح للداخل والخارج.
(13) يجب أن يتأكد محضر المختبر من فصل الكهرباء وإغلاق الغاز والماء عند انتهاء العمل بالمختبر يومياً ما لم يكن هناك أجهزة تلزمها الكهرباء باستمرار مثل الثلاجات أو أجهزة تكييف الهواء لظروف معينة
(14) يجب على محضر المختبر إجراء التفتيش الدوري على توصيلات الغاز والمياه والمجاري والكهرباء للتأكد من سلامتها والإبلاغ عن أي خلل بها فور اكتشافه.
(15) يجب على محضر المختبر التأكد من توفير التهوية المناسبة والإضاءة المناسبة بالمختبر.
(16) يجب التأكد من أن غرفة الغازات (غرفة التجارب) محكمة الغلق لمنع تسرب الغازات الضارة منها أثناء إجراء التجارب الخطرة وأن تكون مزودة بمروحة سحب مناسبة.
المراجع: – كتاب تجارب في الكيمياء التحليلية (التحليل الكمي الحجمي والوزني) / مسعود فرج أبو سته / كلية العلوم – جامعة سبها
 تعرف على علم الكيمياء
تعرف على علم الكيمياء