
قبل البدء في هذا الدرس يمكنك مراجعة القوانين الخاصة بالقانون الأول للديناميكا الحرارية والمستخدمة في حل المسائل وذلك من خلال مراجعة الموضوع الآتي: (انقر على الموضوع لقرأته): القانون الأول للديناميكا الحرارية First Law of Thermodynamics
نص القانون الأول للديناميكا الحرارية
القانون الأول في الثیرمودینامیك مرادف لقانون حفظ الطاقة ، وینص على أن:
(الطاقة لا تفنى ولا تستحدث (تخلق من عدم) ولكن یمكن فقط نقلھا من مكان الى آخرأو تحویلھا من شكل الى آخر أثناء التفاعلات أو التغیرات الكیمیائیة).
أو
(الطاقة الكلیة لنظام معزول تظل ثابتة ویمكن تحول الطاقة من صورة الى أخرى).
الصياغة الرياضية للقانون الأول للديناميكا الحرارية
ΔE = q + w
ΔE = مقدار التغیر في الطاقة الداخلیة للنظام
q = كمیة الحرارة الممتصة أو المنبعثة بواسطة النظام.
w = الشغل المبذول على أو بواسطة النظام.
ملاحظات هامة
– بعض المراجع تكتب القانون الأول في الثیرمودینامیك ریاضیاً على الصورة ΔE = q + w بدلاً من الصورة ΔE = q – w وكلاهما صحیح لأن كلاً منھم أعطى الشغل المبذول على النظام أو المبذول بواسطة النظام إشارة مخالفة.
– ففي القانون ΔE = q – w إذا كان الشغل المبذول بواسطة النظام تكون إشارته موجبة، أما إذا كان الشغل مبذولاً على النظام تكون إشارته سالبة.
– ففي القانون ΔE = q + w إذا كان الشغل المبذول بواسطة النظام تكون إشارته سالبة، أما إذا كان الشغل مبذولاً على النظام تكون إشارته موجبة.
– في المسائل الحسابية سنعتمد العلاقة: ΔE = q + w
– جدول يوضح ملخص لإشارة الشغل وكمية الحرارة:

مسائل محلولة على القانون الأول للديناميكا الحرارية
مثال (1): إذا كان الشغل المبذول عندما ضغط غاز في اسطوانة (299 J) یساوي وخلال هذه العملیة انتقلت من الغاز إلى المحیط كمیة من الحرارة مقدارھا (70.3 J) فاحسب التغیر في الطاقة الداخلیة للغاز.
الحل:
– بما أن كمیة الحرارة تنطلق من النظام إلى المحیط فالحرارة مفقودة وبالتالي إشارتھا تكون بالسالب أي (q = -70.3 J)
– وبما أن الغاز ینكمش (یعمل علیه شغل من النظام) فقیمته بالموجب (w = +)
– بتطبیق القانون الأول في الثیرمودینامیك:
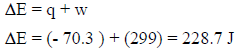
ولأن قیمة الطاقة الداخلیة بالموجب، فإن الطاقة الداخلیة للغاز تزداد بمقدار (228.7 J)
مثال (2): عند درجة حرارة ثابتة، اكتسب غاز كمیة حرارة مقدارھا (30 J) فتمدد الغاز وبذل شغلاً على المحیط مقداره (130 J)
(أ) احسب التغیر في الطاقة الداخلیة للنظام.
(ب) احسب التغیر في الطاقة الداخلیة للمحيط.
الحل:
(أ) حساب التغیر في الطاقة الداخلیة للنظام:
– نتبع العلاقة التالیة:
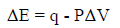
ولكن هذه العلاقة لا یمكن تطبیقھا ھنا بسبب أن التغیر في الحجم والضغط غیر معلومین، ولكن حاصل ضربھما وھو الشغل معلوم، لذلك نطبق العلاقة:
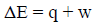
– (q)ھي كمیة الحرارة، ونظراً لأن النظام اكتسبھا فتكون قیمتھا بالموجب (q = +30 J)
– (w) الشغل، ونظراً لأن الغاز تمدد وبذل شغلاً على المحیط فإن قیمته (w = -130 J)
– بالتعویض بھذه القیم نحصل على التغیر في الطاقة الداخلیة للنظام كما یلي:
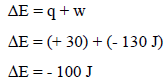
– بما أن قیمة الطاقة الداخلیة بالسالب، فإن ھذا یعني أن الطاقة الداخلیة للنظام قلت بمقدار (100 J)
(ب) حساب التغیر في الطاقة الداخلیة للمحیط:
– في هذه الحالة فإن إشارات كمیة الحرارة والجول ھي بعكس ما أعطیت للنظام في الفقرة (أ)
– حيث نطبق العلاقة:
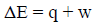
– (q)ھي كمیة الحرارة التي فقدها المحيط (اكتسبها) النظام ، وتكون قیمتھا بالسالب (q = -30 J)
– (w) هو الشغل الذي اكتسبه المحيط (بذله النظام)، وبالتالي فإن إشارته تكون موجبة (w = +130 J)
– بالتعویض بھذه القیم نحصل على التغیر في الطاقة الداخلیة للمحیط كما یلي:
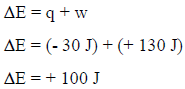
– نلاحظ أن قیمة التغیر في الطاقة الداخلیة للمحیط بالموجب، وبالتالي فإنھا زادت بمقدار (100 J) وكلا الإجابتین في الفقرتین (أ) و (ب) تؤیدان قانون حفظ الطاقة، حیث أن النظام فقد (100 J) من طاقته واكتسبھا المحیط.
مثال (3): ضغطت أسطوانة تحتوي على غاز، فكان الشغل المنجز (300 J) فانتقلت حرارة مقدارھا (70 J) من الغاز إلى المحیط. احسب التغیر في طاقة الغاز الداخلیة؟
الحل:
باتباع العلاقة:
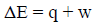
– نظراً لأن الغاز ضغط (انكمش) فإن حجمه قل، وبالتالي التغیر في حجمه یكون بالسالب (ΔV = -) ویكون الشغل حینئذ بالموجب
w = – PΔV(-) = +
w = +300 J
– فنظراً لأنھا انتقلت من الغاز (النظام) إلى المحیط، فھي مفقودة وحینئذ تكون قیمتھا بالسالب (q = -70 J)
– بالتعویض بھذه القیم في المعادلة نحصل على التغیر في طاقة الغاز الداخلیة:
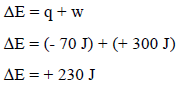
وبالتالي فإن الطاقة الداخلیة للنظام قد زادت بمقدار (230 J)
مثال (4): احسب كمیة الحرارة (q) لنظام یعمل شغلاً على المحیط قدره (20 J) وتتناقص طاقته الداخلیة بمقدار (30 J)
الحل:
– بما أن النظام عمل شغلاً على المحیط فإنه قد تمدد حجمه (التغیر في حجمه بالموجب) وبالتالي فإن قیمة الشغل بالسالب وفقاً للعلاقة:
w = – PΔV(+) = –
w = -20 J
ویمكن القول أن النظام قد فقد شغلاً وبالتالي فقیمة الشغل بالسالب (w = -20 J)
– بما أن التغیر في الطاقة الداخلیة تناقص فبالتالي قیمة التغیر في الطاقة الداخلیة بالسالب (ΔE = – 30 J)
– من ھنا یمكن التطبیق في القانون التالي لحساب كمیة الحرارة:
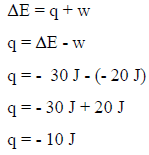
– بما أن (q = -) فإن ھذا یعني أن النظام قد فقد كمیة من الحرارة.
مثال (5): إذا تم ضغط حجم (400 ml) من غاز إلى حجم (200 ml) تحت ضغط خارجي قدره (3 atm) أوجد قيم (ΔE, w, q) للغاز إذا امتص الغاز كمية من الحرارة (13 J) ثم أوجد قيمة ΔE للوسط المحيط.
الحل:
أولاً/ كمية الحرارة (q)
من السؤال فإن كمیة الحرارة امتصت من قبل الغاز وبالتالي فإن (q = +13 J)
ثانیاً/ حساب الشغل (w)
بما أن الغاز قد ضغط (انكمش) فإن التغیر في الحجم بالسالب، وتكون قیمة الشغل الذي اكتسبه النظام بالموجب كما یلي:
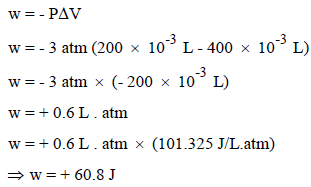
ثالثاً/ حساب التغیر في الطاقة الداخلیة للنظام
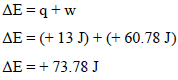
رابعاً/ التغیر في الطاقة الداخلیة للمحیط
إن التغیر في الطاقة الداخلیة للمحیط ھو نفسه للنظام ولكن بعكس الإشارة أي (ΔE = – 73.78 J)
المراجع: أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية






السلام عليكم ورحمة الله وبركاته لااستطيع تحميل الكتاب مسائل محلولة في الديناميكيا الحرارية
هذا للقراءة فقط أخى وليس للتحميل
ب- أسطوانة غاز مزودة بمكبس حر الحركة، عديم الوزن مساحة مقطعه 0.01 m2 ،وضع في الاسطوانة كمية من الغاز بدرجة حرارة 2 7 cº و بضغط يعادل الضغط الجوي ( 1 atm ) فاتزن المكبس عندما كان حجم الغاز داخل الاسطوانة V. اذا سخن الغاز ليصبح حجمه 1.5 حجمه الاصلي. احسب درجة الحرارة المئوية التي وصل اليها الغاز علما بأنه قد تم اضافة كتلة مقدارها 50 kg الى المكبس ليصل الى حالة اتزان. (25 علامة )