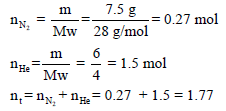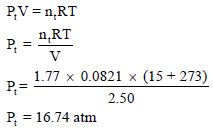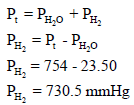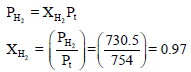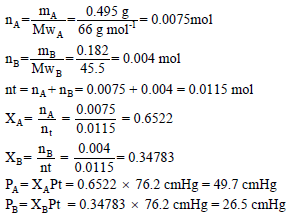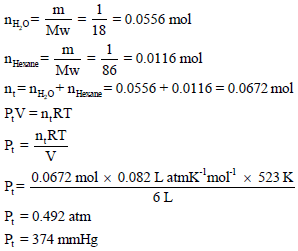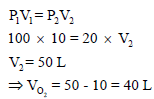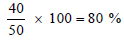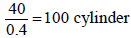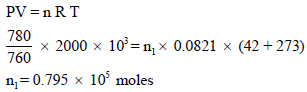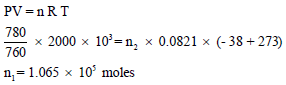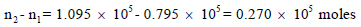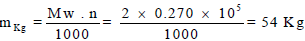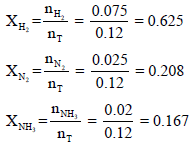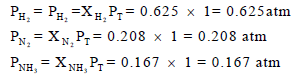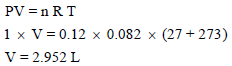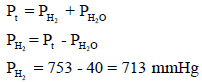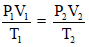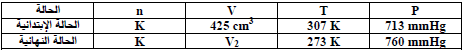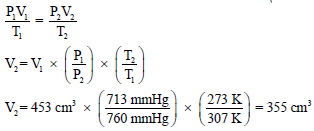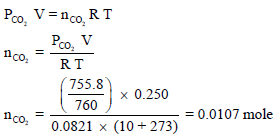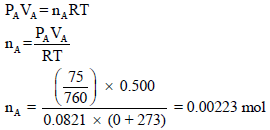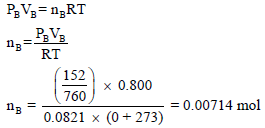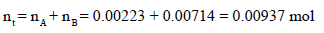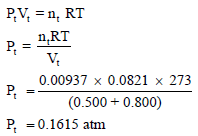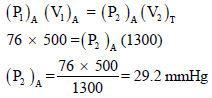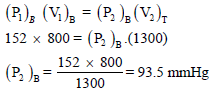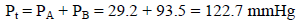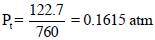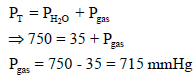
تكلمنا في الدروس السابقة عن قانون دالتون للضغوط الجزيئية Dalton’s Law of Partial Pressure (يمكنك مراجعة الدرس من خلال هذا الرابط).
وفى هذا الدرس سوف نتناول بعض المسائل المحلولة على هذا القانون.
مثال (1): قانون دالتون Dalton’s Law
احسب الضغط المبذول لخليط من غازين (7.5 g) نيتروجين (N2) و (6 g) هيليوم (He) في وعاء حجمه (2.5L) ودرجة حرارته (15 Co). (علماً بأن الكتل الذرية: .(N = 14, He = 4
الحل:
أولاً/ نحسب عدد مولات كل غاز ثم نوجد عدد المولات الكلي كما یلي:
ثانياً/ باستخدام القانون العام للغازات المثالیة كما يلي:
مثال (2): قانون دالتون Dalton’s Law
احسب الكسر المولي لغاز الھیدروجین بعد عملية التحلیل الكهربي للماء عند درجة حرارة 23Co إذا كان ضغط الماء هو 23.50 mmHg والضغط الكلي 754mmHg؟
الحل:
أولاً / نحسب ضغط الھیدروجین بتطبيق قانون دالتون للضغوط الجزئية كما يلي:
ثانياً/ لحساب الكسر المولي للھیدروجین كما يلي:
مثال (3): قانون دالتون Dalton’s Law
خليط من غازين (A) وكتلته (0.495 g) ووزنة الجزيئي(66) ، وغاز (B) وكتلته (0.182 g) ووزنه الجزيئي(45.5) وكان الضغط الكلي للخليط (76.2 cmHg) احسب الضغط الجزئي لكل غاز؟
الحل:
مثال (4): قانون دالتون Dalton’s Law
خلط جرام من الماء مع جرام من الهكسان (C6H14) في وعاء مقفل سعته 6 لتر ، وسخن الخليط حتى درجة حرارة 250 Co ، فتحولت المادتان إلى الحالة الغازية. أحسب ضغط الخليط؟
الحل:
مثال (5): قانون دالتون Dalton’s Law
(10 L) من غاز الأكسجين في اسطوانة تحت ضغط (100 atm) أردنا ملء اسطوانات صغيرة حجم كل منها (0.4 L) وتحت ضغط (20 atm).
(أ) احسب نسبة الأكسجین المستعملة لھذه العملیة من الأسطوانة ذات سعة (10 L)؟
(ب) كم اسطوانة صغیرة تكفي لھذه العملیة؟
الحل:
على فرض أن درجة الحرارة ثابتة وأن الغاز یسلك سلوكاً مثالیاً. وبما أن درجة الحرارة ثابتة، فإنه وحسب قانون بویل كما يلي:
(حجم الأكسجين المتحول الى الأسطوانات الصغیرة = 40 L) لذلك:
(أ) نسبة الأكسجین المستعمل لھذه العملیة كما يلي :
(ب) عدد الأسطوانات المستعملة لھذه العملیة كما يلي:
مثال (6): قانون دالتون Dalton’s Law
أعلى درجة حراریة تصل إلیھا أسطوانة غاز في فصل الصیف (42Co) وأقل درجة حرارية في الشتاء (-38Co). كم كیلو غرام زیادة من غاز الھیدروجین تستطیع ھذه الأسطوانة ذات سعة (2000 m3) أن تستوعب في أقل درجة حراریة من أعلى درجة حراریة إذا كان الضغط داخل الأسطوانة ھو (780 mmHg) افرض سلوك الغاز مثالیاً.
الحل:
عدد مولات غاز الھیدروجین في فصل الصیف:
عدد مولات غاز الھیدروجین في فصل الشتاء:
الزیادة في عدد مولات الھیدروجین في الصیف عنه في الشتاء:
ولحساب الزیادة في وزن الھیدروجین (حیث الوزن الجزیئي لغاز الھیدروجین (2g/mol):
مثال (7):
خليط متكون من (0.15 g) من الهيدروجين ، (0.700 g) من النيتروجين ، (0.340 g) من الأمونيا تحت ضغط كلي مقداره (1 atm) ودرجة الحرارة (27 Co). أحسب:
(أ) احسب الكسر المولي لكل غاز
(ب) احسب الضغط الجزئي لكل غاز
(جـ) أحسب الحجم الكلي.
الحل:
(أ) حساب عدد المولات لكل غاز كما يلي:
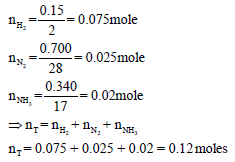
ویكون الكسر المولي لكل غاز كما يلي:
(ب) حساب الضغط الجزئي للغازات كما يلي:
(جـ) الحجم الكلي كما يلي:
مثال (8):
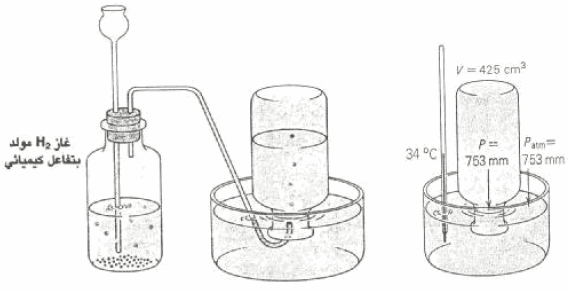
جمعت كمية من غاز في زجاجة مقلوبة (الشكل التالي) فوق سطح الماء. وعندما تساوي سطح الماء داخل الزجاجة وخارجها كان الضغط داخل الزجاجة مساوياً للضغط الجوي وقيمته (753 mmHg) ، وإذا كانت درجة حرارة الماء والغاز داخل الزجاجة (34 Co) وكان الحيز الذي يوجد به الغاز داخل الزجاجة ( (425 Cm3.
فما هو حجم غاز الهيدروجين الجاف عند ضغط (760 mmHg) ودرجة حرارة (0 Co) علماً بأن ضغط بخار الماء عند (34 Co) يساوي .(40mmHg)
الحل:
یكون الھیدروجین فوق سطح الماء مختلطاً ببخار الماء وبذلك یكون الضغط داخل الزجاجة (753 mmHg) مكوناً من الضغط الجزئي للهيدروجين وضغط بخار الماء. ویمكن إیجاد ضغط الھیدروجین الجاف اعتماداً على قانون دالتون كما يلي:
ویستخدم الآن ضغط الھیدروجین الجاف لإیجاد حجمه عند (0 Co) وتحت ضغط (760 mmHg) وذلك بتطبيق المعادلة العامة للغازات (مع ثبات عدد المولات n = K) كما يلي:
وبالاستعانة بالجدول التالي:
وبالتعويض في القيم كما يلي:
مثال (9):
(0.250 L) من غاز أول أكسيد الكربون (CO) جمعت في جرة مقلوبة فوق الماء عند درجة حرارة (10 Co) علماً بأن الضغط الجوي (765 mmHg) احسب عدد المولات لغاز لأول أكسيد الكربون المتجمع. علماً بأن ضغط بخار الماء عند هذه الدرجة الحرارية هو (9.2 mmHg)
الحل:
الضغط في الإناء ھو مجموع الضغط الجزئي لغاز أول أكسد الكربون CO والماء:
ومن القانون العام للغازات المثالیة فإن:
مثال (10):
إناء حجمه (500 cm3) يحتوي على الغاز (A) الذي يسلط ضغطاً مقداره (76 mmHg) عند صفر درجة مئوية وإناء آخر حجمه (800 cm3) من غاز (B) الذي يسلط ضغطاً مقداره (152 mmHg) ربط الإناءان فما هو الضغط الكلي للنظام عند صفر درجة مئوية.
الحل:
نحسب عدد المولات الكلي nt ، ثم نحسب الحجم الجديد الكلي (Vt)، ثم نطبق بقيمتها في العلاقة:
PtVt = nt R T
أولاً / حساب عدد مولات الغاز A
ثانیاً/ حساب عدد مولات الغاز B
ثالثاً/ حساب عدد المولات الكلي:
وعند وصل الإنائین مع بعضھما سیصبح لدینا حجماً جدیداً ھو (Vt = VA + VB) وعدد مولات جدید ھو (nt = nA + nB) وضغط جديداً مجهولاً (Pt):
طريقة أخرى للحل:
وفیھا نوجد ضغط كل غاز على حدة ثم نجمعھما:
أولاً/ حساب الضغط الجزئي للغاز A
ثانياً/ حساب الضغط الجزئي للغاز B
ثالثاً/ حساب الضغط الكلي للغازین كما يلي:
ولتحویلھا لوحدة (atm):
مثال (11): إذا كان ضغط الغاز المبلل بالماء (750 mmHg) وكان ضغط بخار الماء (35 mmHg) كم يكون ضغط الغاز جافاً؟
الحل:
تم استكمال باقي المسائل على قانون دالتون للضغوط الجزيئية في الدرس التالي: مسائل على قانون دالتون Dalton Law للضغوط الجزيئية (الجزء الثاني)
المراجع: – أسس الكيمياء العامة والفيزيائية- الجزء الأول. عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية
 تعرف على علم الكيمياء
تعرف على علم الكيمياء