محتويات الموضوع
ما هو عنصر الليثيوم؟
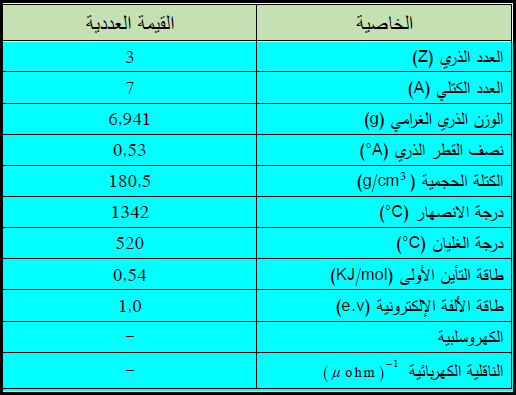
– الليثيوم Li عنصر من عناصر الجدول الدوري، العدد الذري = 3، العدد الكتلي = 7
– يرمز له بالرمز: 7Li3
– التوزيع الإلكتروني لعنصر الليثيوم: 1S2 , 2S1
– الليثيوم عبارة عن معدن أبيض فضي، ينتمي إلى مجموعة المعادن الأساسية في الجدول الدوري للعناصر
– الليثيـوم أخف المعادن، وكثافته هي نصف كثافة الماء تقريباً.
– كما يعتبر الليثيأوم من أقوى العوامل المختزلة على الإطلاق، وهو يتفاعل ويتأكسد بسرعة في الهواء والماء.
– نظراً لخاصياته فهو يدخل في تركيب البطاريات وكذلك في بعض الأدوية المستعملة في معالجة الأمراض العصبية والاكتئاب في صورة كربونات الليثيـوم.
– الجدول التالي يوضح بعض الخواص العامة لعنصر الليثيـوم كما يلي:
اكتشافه ووجوده في الطبيعة
– اكتشف عنصر الليثيوم في عام 1817 من قبل (أفيدسونArfredson ) بالسويد وذلك من خامة البيتاليت
– مصدر اسم عنصر الليثيـوم من اليونانية (Lkthos) بمعنى حجر إشارة إلى أصله المعدني.
– في عام 1818 استطاع كل من (براند Brandé) و (ديفي Davy) من تحضير كميات قليلة منه بالتحليل الكهربائي لأكسيد الليثيـوم.
– كما يعتبر الليثيوم من العناصر النادرة 0.0065 % فهو غير موجود بشكل حر.
– بسبب نشاطه التفاعلي العالي يوجد دائماً متحداً مع عنصر أو أكثر في مركبات كيميائية.
– كما يشكل الليثيوم نسبة ضئيلة في الكثير من الصور البركانية، كما يوجد في المياه ذات تركيزات الأملاح العالية. إلا أن خاماته منتشرة في كل من أوروبا وآسيا وافريقيا وأمريكا وأهمها:
- السبوديومين: Li [Al Si2 O6]
- والليبيدولين: K2 Li3 Al4 Si7 O21 (OH , F)3
- والبيتاليت: Li Al Si4 O10
- والأملبيكونيت (Ambygonite): Li Al (F ,OH ) PO4
طرق تحضير الليثيوم
– تتألف الخلية من صفيحة من الفولاذ تضم الصهارة وتقوم مقام المهبط، والمصعد من الغرافيت.
– ينصهر المزيج عند حوالي (درجة انصهار كلوريد الليثيـوم 610Co يتحرر الليثيـوم على المهبط الفولاذي ويطفو على سطح الصهارة ويتحرر الكلور على المصعد.
– يجب إضافة كلوريد الليثيـوم لتعويض ما يتحلل منه.
الخواص الكيميائية لعنصر الليثيوم
(1) التفاعل مع الأكسجين
– الليثيـوم النقي جدا لا يتفاعل مع الأكسجين الجاف في الدرجة العالية من الحرارة إلا أنه في الدرجات الأعلى من 100 Co يتفاعل معه ليشكل الأكسيد LiO2.
– ويمكن أن يتفاعل هذا الأكسيد مع الماء ليعطي هيدروكسيد الليثيـوم:
(2) التفاعل مع الماء
– يتحد الليثيوم مع الماء بشدة مشكلا هيدروكسيد الليثيـوم وغاز الهيدروجين، ولا يكون هذا التفاعل عنيفا حتى أن الليثيـوم لا ينصهر والهيدروجين المتحرر لا يشتعل كما في حالة المعادن الأخرى:
(3) التفاعل مع أشباه المعادن
– يتفاعل الليثيوم مع الهيدروجين عندما يكون مصهوراً (أي فوق الدرجة 600 Co) كما بالمعادلة الآتية:
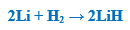
– يتفاعل الليثيـوم أيضا مع الكبريت ليعطي الكبريتدات ومع الفوسفور ليعطي الفوسفيدات وذلك كما بالمعادلات الآتية:
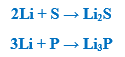
– كما يتفاعل الليثيـوم مع الآزوت ببطء في الدرجة العادية من الحرارة وبسرعة عند درجات أعلى ليشكل النتريد Li3N كما بالمعادلة الآتية:
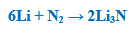
(4) التفاعلات الأخرى
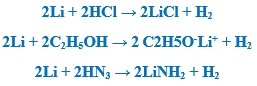
– يمكن أن يتفاعل الليثيوم مع الأحماض والكحول الإيثيلي وغاز النشادر بوجود وسيط وحرارة حيث ينطلق غاز الهيدروجين و كلوريد الليثيـوم أو إيتيلات أو أميد الليثيـوم كما بالمعادلات الآتية:
– كما يختزل الليثيوم الأكاسيد وهاليدات المعادن الأخرى إلى المعدن فمثلاً يستطيع اختزال كلوريد البيريليوم كما بالمعادلة الآتية:
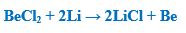
استخدامات عنصر الليثيوم
(1) يدخل الليثيوم في صناعة الأدوية.
(2) يستعمل الليثيـوم على نطاق واسع في الكيمياء العضوية مثل مركب هيدريد الليثيـوم والألمنيوم Li– Al H4 – الذي يعتبر من العوامل المختزلة القوية.
(3) يستخدم في صناعة بطاريات السيارات لكونه موصل للكهرباء.
(4) يستخدم في الطب النفسي في ضبط نوبات الاكتئاب والهوس للمرضى الذين يعانون من الاضطراب الوجداني ثنائي القطبين.
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر
 تعرف على علم الكيمياء
تعرف على علم الكيمياء