
القوى
النسبية للأحماض والقواعد Relative Strength of Acids and Bases
** قوة أي
حمض HA في
محلول مائي هو مقياس لقدرته على منح بروتون (H+) لجزئي الماء.
حمض HA في
محلول مائي هو مقياس لقدرته على منح بروتون (H+) لجزئي الماء.

** ولأي
مدى يمكن لهذا التفاعل أن يمضي من اليسار إلى اليمين هو أيضاً مقياس للقاعدة
القرينة (A–) لتقبل بروتوناً (A+) من (H3O+).
مدى يمكن لهذا التفاعل أن يمضي من اليسار إلى اليمين هو أيضاً مقياس للقاعدة
القرينة (A–) لتقبل بروتوناً (A+) من (H3O+).

(أ) فإذا
تغلب التفاعل الممثل بالمعادلة (i) على التفاعل الممثل بالمعادلة (ii) كان الحمض (HA) قوياً وقاعدته القرينة (A–) ضعيفة.
تغلب التفاعل الممثل بالمعادلة (i) على التفاعل الممثل بالمعادلة (ii) كان الحمض (HA) قوياً وقاعدته القرينة (A–) ضعيفة.
مثال:
HCl + H2O → H3O+ + Cl–
HCl حمض قوي وقاعدته القرينة (Cl–) ضعيفة ويمكننا استنتاج أن HCl أقوى من (H3O+) لمقدرته على منح بروتون (H+) للماء والماء أقوى كقاعدة من (Cl–).
(ب) فإذا
تغلب التفاعل الممثل بالمعادلة (ii) على التفاعل الممثل بالمعادلة (i) كان الحمض (HA) ضعيفاً وقاعدته القرينة (A–)
قوية
تغلب التفاعل الممثل بالمعادلة (ii) على التفاعل الممثل بالمعادلة (i) كان الحمض (HA) ضعيفاً وقاعدته القرينة (A–)
قوية
مثال:
CH3COOH + H2O ↔ H3O+
+CH3COO–
+CH3COO–
HCN +H2O → H3O+ + CN–
حمض
الأستيك والسيانيك أحماض ضعيفة وقواعدها (CH3COO–)، (CN–) قواعد قوية.
الأستيك والسيانيك أحماض ضعيفة وقواعدها (CH3COO–)، (CN–) قواعد قوية.
مما
سبق نستنتج أن:
سبق نستنتج أن:
(1) القاعدة
القوية يمكنها جذب البروتون بقوة ولذلك فهي قرينة الحمض الضعيف
القوية يمكنها جذب البروتون بقوة ولذلك فهي قرينة الحمض الضعيف
(2) في
تفاعل لحمض وقاعدة فإن الاتزان يؤدي إلى تكوين الحمض والقاعدة الأضعف.
تفاعل لحمض وقاعدة فإن الاتزان يؤدي إلى تكوين الحمض والقاعدة الأضعف.
ففي تفاعل
الماء مع حمض HCl يكون تركيز أيون الهيدرونيوم (H3O+) وأيون الكلوريد (Cl–) عند الاتزان عالياً بينما
في تفاعل حمض الاستيك (CH3COOH) والماء يكون تركيز أيون الهيدرونيوم (H3O+) وأيون الاسيتات (CH3COO–) منخفضاً وهما الحمض الأقوى القاعدة الأقوى.
الماء مع حمض HCl يكون تركيز أيون الهيدرونيوم (H3O+) وأيون الكلوريد (Cl–) عند الاتزان عالياً بينما
في تفاعل حمض الاستيك (CH3COOH) والماء يكون تركيز أيون الهيدرونيوم (H3O+) وأيون الاسيتات (CH3COO–) منخفضاً وهما الحمض الأقوى القاعدة الأقوى.
ترتيب
الأحماض والقواعد
* الجدول
التالي يوضح ترتيب الأحماض والقواعد وفقاً لقوتها النسبية:
التالي يوضح ترتيب الأحماض والقواعد وفقاً لقوتها النسبية:
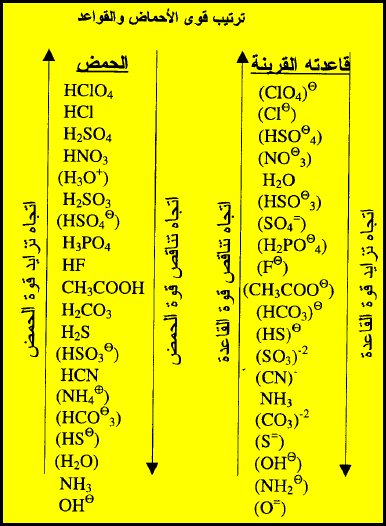
** في
هذا الجدول وفى العمود الأيسر وتبت الأحماض وقفاً لتناقص قوتها (وهي مقدرتها على
منح H+) ، وفى العمود الأيمن رتبت
القواعد القرينة لهذه الأحماض وفقاً لتزايد قوتها ( وهي مقدرتها على الأتحاد أو
استقبال H+).
هذا الجدول وفى العمود الأيسر وتبت الأحماض وقفاً لتناقص قوتها (وهي مقدرتها على
منح H+) ، وفى العمود الأيمن رتبت
القواعد القرينة لهذه الأحماض وفقاً لتزايد قوتها ( وهي مقدرتها على الأتحاد أو
استقبال H+).
** أذا أخذنا الحمض الأول (HClO4) نجده الأقوى حمضية وقاعدته القرينة (ClO4–) الأضعف قاعدية أي أن العلاقة العكسية بين
الحمض وقاعدته القرينة واضحة.
الحمض وقاعدته القرينة واضحة.
التأثير
المسوى Leveling effect
** لو
أخذنا الأحماض الثلاثة الآتية وهي الأقوى في العمود الأيسر في الجدول السابق
وفاعلناها مع الماء.
أخذنا الأحماض الثلاثة الآتية وهي الأقوى في العمود الأيسر في الجدول السابق
وفاعلناها مع الماء.
HClO4 (aq) + H2O → H3O+
+ ClO4–
+ ClO4–
HCl (aq) + H2O → H3O+ + Cl–
HNO3 (aq) + H2O → H3O+
+ NO3–
+ NO3–
نجد
أن كلا من هذه الأحماض الثلاثة السابقة وهي أقوى من الحمض (H3O+) وينتج دائماً الحمض الضعيف (H3O+) ونري أن المحاليل المائية
لهذه الأحماض الثلاثة لنفس تراكيزها تبدو وكأنها متساوية وأن الخاصية الحمضية لهذه
المحاليل المائية تعود فقط لأيون الهيدرونيوم (H3O+) الذى تتجه هذه الأحماض
الثلاثة بمدى متساوي في تفاعلها مع الماء ، ويمكن القول إ، الماء سوى بين قوة هذه الأحماض
أو أن الماء له تأثير مساو للأحماض الأقوى من (H3O+) وعليه يمكن القول أن أقوى
حمض في المحلول المائي هو الحمض القرين للماء وهو أيون الهيدرونيوم (H3O+) ويجب الا ننسى أن قوة الرباط بين ذرة (H) والأيون السالب في هذه الاحماض
القوية الثلاثة يختلف في قطبيته حتى ولو كان تأينها في الماء لا يبين هذا الاختلاف.
أن كلا من هذه الأحماض الثلاثة السابقة وهي أقوى من الحمض (H3O+) وينتج دائماً الحمض الضعيف (H3O+) ونري أن المحاليل المائية
لهذه الأحماض الثلاثة لنفس تراكيزها تبدو وكأنها متساوية وأن الخاصية الحمضية لهذه
المحاليل المائية تعود فقط لأيون الهيدرونيوم (H3O+) الذى تتجه هذه الأحماض
الثلاثة بمدى متساوي في تفاعلها مع الماء ، ويمكن القول إ، الماء سوى بين قوة هذه الأحماض
أو أن الماء له تأثير مساو للأحماض الأقوى من (H3O+) وعليه يمكن القول أن أقوى
حمض في المحلول المائي هو الحمض القرين للماء وهو أيون الهيدرونيوم (H3O+) ويجب الا ننسى أن قوة الرباط بين ذرة (H) والأيون السالب في هذه الاحماض
القوية الثلاثة يختلف في قطبيته حتى ولو كان تأينها في الماء لا يبين هذا الاختلاف.
** لو
درسنا الفرق بين قوة الأحماض الثلاثة HCl، HBr، HI في مذيب أقل قاعدية من
الماء نجدها تختلف كثيراً عن بعضها في قابليتها أو استعدادها لمنح بروتونها لهذا
المذيب. فإذا أخذنا الأحماض الثلاثة HCl، HBr، HI الهالوجينية وإذا أذيبت
في مذيب مثل الميثانول (CH3OH) وهو أقل قاعدية من الماء فإن مدى تأينها
يزداد بالترتيب HCl ، HBr ، HI موضحاً أن جزئ الماء
كقاعدة قوية مقارنة بالقواعد القرينة I– , Br– , Cl– للأحماض القوية HI , HBr, HCl حيث التأين يكون تاماً
تقريباً لهذه الأحماض في محاليلها المائية، بينما نرى أو على العكس في ذلك أن
الأحماض الأضعف أو الأقل قوة من (H3O+) لا تسوى قوتها بالماء أي أن الأحماض الثلاثة
الأتية الأستيك، الكربونيك والأمونيا وكل الأحماض الأقل قوة من (H3O+) ولنفس التركيز تظهر اختلافاً واضحاً في درجة
تأينها.
درسنا الفرق بين قوة الأحماض الثلاثة HCl، HBr، HI في مذيب أقل قاعدية من
الماء نجدها تختلف كثيراً عن بعضها في قابليتها أو استعدادها لمنح بروتونها لهذا
المذيب. فإذا أخذنا الأحماض الثلاثة HCl، HBr، HI الهالوجينية وإذا أذيبت
في مذيب مثل الميثانول (CH3OH) وهو أقل قاعدية من الماء فإن مدى تأينها
يزداد بالترتيب HCl ، HBr ، HI موضحاً أن جزئ الماء
كقاعدة قوية مقارنة بالقواعد القرينة I– , Br– , Cl– للأحماض القوية HI , HBr, HCl حيث التأين يكون تاماً
تقريباً لهذه الأحماض في محاليلها المائية، بينما نرى أو على العكس في ذلك أن
الأحماض الأضعف أو الأقل قوة من (H3O+) لا تسوى قوتها بالماء أي أن الأحماض الثلاثة
الأتية الأستيك، الكربونيك والأمونيا وكل الأحماض الأقل قوة من (H3O+) ولنفس التركيز تظهر اختلافاً واضحاً في درجة
تأينها.
** وكما سوى الماء بين قوة الأحماض فإنه أيضاً يسوى بين قوة القواعد ونجد أن أقوى
قاعدة يمكنها التواجد في المحلول المائي هو أيون الهيدروكسيد (OH–) وهو القاعدة القرينة للماء (H2O) فالقواعد القوية في ذيل
العمود الأيمن وهي قواعد أقوي من الماء نجد أن أيون الأكسيد (O-2) وأيون الأميد (NH2–) تتفاعل مع الماء بواسطة نزع بروتونه تفاعلاً
تاما ً في اتجاه واحد.
قاعدة يمكنها التواجد في المحلول المائي هو أيون الهيدروكسيد (OH–) وهو القاعدة القرينة للماء (H2O) فالقواعد القوية في ذيل
العمود الأيمن وهي قواعد أقوي من الماء نجد أن أيون الأكسيد (O-2) وأيون الأميد (NH2–) تتفاعل مع الماء بواسطة نزع بروتونه تفاعلاً
تاما ً في اتجاه واحد.
O-2 + H2O → OH– + OH–
NH2– + H2O → NH3 + OH–
وهكذا
تبدو هذه القواعد القوية وكأنها لها نفس القوة بتفاعلها مع الماء وأن الماء سوي
بين قوة هذه القواعد كما سوي بين قوة الأحماض القوية، بينما نرى العكس من ذلك أن
الأضعف من (OH–) ولنفس التركيز تختلف قواها النسبية أو تختلف
درجة تأينها وتقاس درجة تأينها بتفاعلها مع الماء منتجة الهيدروكسيد (OH–).
تبدو هذه القواعد القوية وكأنها لها نفس القوة بتفاعلها مع الماء وأن الماء سوي
بين قوة هذه القواعد كما سوي بين قوة الأحماض القوية، بينما نرى العكس من ذلك أن
الأضعف من (OH–) ولنفس التركيز تختلف قواها النسبية أو تختلف
درجة تأينها وتقاس درجة تأينها بتفاعلها مع الماء منتجة الهيدروكسيد (OH–).
نسبة
التأين
التأين
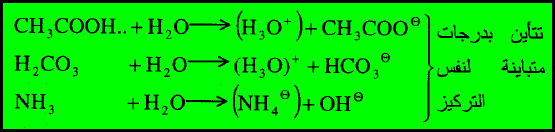
المراجع
– مبادئ الكيمياء العامة (نظري – مسائل محلولة). محي الدين البكوش – نوري بسيبسو – ياسر حورية – نبيل شيخ قروش، الطبعة الثانية (2003م) / شركة الجا للنشر العلمي – طرابلس.
 تعرف على علم الكيمياء
تعرف على علم الكيمياء





