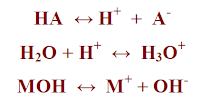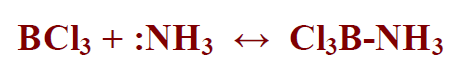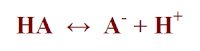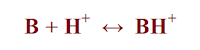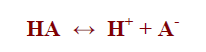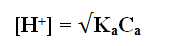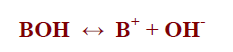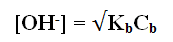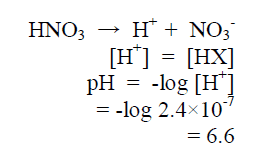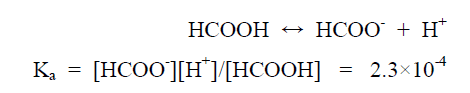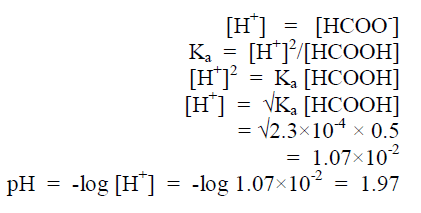– في هذا الموضوع سيتم مناقشة الأتزان في الأحماض والقواعد وتأين الأحماض والقواعد Acid – base equilibrium وكيفية اشتقاق قوانين pH للأحماض والقواعد القوية وللأحماض والقواعد الضعيفة بالتفصيل.
محتويات الموضوع
تعريف الأحماض والقواعد
– تعتبر الأحماض والقواعد من أهم المواد الكيميائية.
– يعتبر أرهينيوس أول من عرف الأحماض بناء على التفكك الكهربي في الماء كما يلي:
- الأحماض هي المواد التي تعطي أيون الهيدرونيوم.
- القواعد هي المواد التي تعطي أيون الهيدروكسيد
كما هو موضح في المعادلات التالية:
– وهذا التعريف محدود ولا يشمل التأين في الأوساط اللامائية ولذا فإن برونستد ولوري عرفا الأحماض والقواعد كما يلي:
- الحمض بأنه المادة الواهبة للبروتونات
- والقاعدة بأنها المادة التي تستقبل البروتونات
كما في المعادلة التالية:
ولهذا فالحمض هو المادة التي تطلق البروتون لتكون القاعدة والقاعدة هي المادة التي تكتسب البروتون لتكون الحمض.
– الإ أن هناك مواد أخرى لها صفات حامضية وقاعدية مع أنها لا تحتوي على بروتونات.
– وهذا ما دعا لويس إلى تعريف الحمض والقاعدة كما يلي:
- الحمض بأنه المادة التي تكتسب زوجَا من الإلكترونات
- والقاعدة بأنها المادة التي تعطي زوجَا من الإلكترونات مكونة رابطة تساهمية
كما في المعادلة التالية:
– ولقد وضع يوسانوفيتش تعريف أكثر شمولية يجمع التعريفين السابقين حيث عرف الحمض والقاعدة كما يلي:
- الحمض بأنه المادة التي تعطي بروتون أو كاتيون أو التي تستقبل إلكترون أو أنيون
- والقاعدة بأنها المادة التي تستقبل البروتون أو الكاتيون أو التي تعطي إلكترون أو أنيون.
وحسب تعريف برونستد ولوري يفكك الحمض HA إلى بروتون وقاعدة مقابلة كما يلي:
والحمض والقاعدة المتآصران هنا يسميان الزوج المرافق Conjugate pair كما تتحد القاعدة مع البروتون لتعطي الحمض المقابل كما في المعادلة التالية:
وكما نعلم فإن الأحماض والقواعد قد تكون قوية أي تتأين تأين كامل، أو تكون ضعيفة وتتأين تأين غير كامل أو جزئي.
(1) تأين الأحماض القوية
– تتأين الأحماض القوية تأيناً كاملاً بنسبة 100% ، وذلك فإن الحمض يتحول كلياً إلى أيونات هيدروجين H+
– ولهذا فإنه عند ذوبان الحمض القوي في الماء فإن تركيز أيونات الهيدروجين الناتجة يمثل تركيز الحمض الابتدائي. أي أن:
Ca = [H+]
حيث Ca يمثل تركيز الحمض القوي.
– وفي هذه الحالة يمكن حساب الرقم الهيدروجيني مباشرة من العلاقة الأتية كما يلي:
pH = – log [H+]
(2) تأين الأحماض الضعيفة
– تتأين الأحماض الضعيفة في الماء بشكل غير كامل، وتختلف من حمض إلى آخر حسب قوة الحمض.
– ولهذا فإن تركيز أيونات الهيدروجين الناتجة من تأين الحمض لا يساوي تركيز الحمض الابتدائي.
– ويمكن حسابه إستنادَا على قانون فعل الكتلة بحساب ثابت الإتزان من المعادلة التالية:
حيث يمثل HA الحمض الضعيف ومنه:
Ka = [H+] [A–] / [HA]
– وبما أن تركيز الحمض الضعيف المتبقي = Ca – [H+] ومنها:
Ka = [H+] [A–] / Ca – [H+]
– وبما أن [H+] = [A–] وقيمة [H+] صغيرة جداً بالنسبة Ca ويمكن إهمالها فإن:
Ka = [H+]2 / Ca
[H+]2 = KaCa
وبأخذ اللوغاريتم السالب للطرفين نحصل علي المعادلة الآتية كما يلي :
– log [H+] = – log (KaCa)1/2
– log [H+] = -1/2 log Ka – 1/2 log Ca
وحيث أن – log = p فتصبح قانون pH للأحماض الضعيفة كما يلي
pH = 1/2 pKa – 1/2 log Ca
(3) تأين القواعد القوية
– تتأين القواعد القوية تأينَا كاملاً بنسبة 100% ، وبذلك فإن القاعدة تتحول كليَا إلى أيونات هيدروكسيد
– ولهذا فإنه عند ذوبان القاعدة القوية في الماء فإن تركيز أيونات الهيدروكسيد الناتجة تساوي تركيز القاعدة الإبتدائي، أي أن:
Cb = [OH–]
حيث Cb يمثل تركيز القاعدة القوية، وفي هذه الحالة يمكن حساب الرقم الهيدروجيني للقاعدة القوية من العلاقة الآتية كما يلي:
pOH = – log [OH–]
ثم نطرح القيمة الناتجة من 14 لأن:
pH = 14 – pOH
ويُعرف قيمة الرقم الهيدروجيني للمحلول
(4) تأين القواعد الضعيفة
– تتأين القواعد الضعيفة تأينَا جزئيَا غير كامل، وتختلف النسبة من قاعدة لأخرى حسب قوتها.
– ولهذا فإن تركيز أيونات الهيدروكسيد الناتجة من تأين القاعدة الضعيفة لا يساوي تركيز القاعدة الابتدائي ، ولكن يمكن حسابه بواسطة قانون فعل الكتلة وذلك بحساب ثابت الإتزان من المعادلة الآتية كما يلي:
حيث يمثل BOH القاعدة القوية
Kb = [B+] [OH–] / [BOH]
وبما أن تركيز القاعدة الضعيفة المتبقي = Cb – [OH–] ومنها:
Kb = [B+] [OH–] / Cb – [OH–]
– وبما أن [B+] = [OH–] وقيمة [OH–] صغيرة جداً بالنسبة Cb ويمكن إهمالها فإن:
Kb = [OH–]2 / Cb
[OH–]2 = KbCb
– وبأخذ اللوغاريتم السالب للطرفين نحصل علي المعادلة ألأآتية كما يلي:
– log [OH–] = – log (KbCb)1/2
– log [OH–] = -1/2 log Kb – 1/2 log Cb
– وحيث أن – log = p فأن
pOH = 1/2 pKb – 1/2 log Cb
pOH = pKw – pH
pKw – pH = 1/2 pKb – 1/2 log Cb
pH = pKw – 1/2 pKb + 1/2 log Cb
ويكون القانون الآخير هو قانون pH للقواعد الضعيفة.
قوانين pH للأحماض والقواعد
– يمكن تلخيص القوانين السابقة في الجدول كما يلي:

مسائل محلولة على تأين الأحماض والقواعد
مثال (1): أحسب الرقم الهيدروجيني لحمض النيتريك ذي التركيز M 2.4 × 10-7 ؟
الحل :
– يجب حساب تركيز أيون الهيدروجين [H+] أولاً
– ويعتبر تركيز الهيدروجين مساوي لتركيز الحمض الأصلي لأن حمض النيتريك حمض قوي يتفكك كليَا في الماء كما يتضح من المعادلة الآتية كما يلي:
مثال (2): أحسب الرقم الهيدروجيني لحمض الفورميك ذي التركيز 0.5 M إذا كان Ka= 2.3 × 10-4 ؟
الحل :
– حمض الفورميك حمض ضعيف ولهذا يتأين جزئياً كما يلي:
– ومن المعادلة يتضح أن تركيز أيون الهيدروجين = تركيز أيون الفورمات كما يلي:
المراجع: محاضرات الكيمياء التحليلية “التحليل الحجمى والوزني CHEM 211” . خيرية محمد عبدالله الأحمري – (1430 – 1429) جامعة الملك عبد العزيز- المملكة العربية السعودية.
 تعرف على علم الكيمياء
تعرف على علم الكيمياء