
فكرة تجربة تعيين تركيز كربونات الصوديوم وهيدروكسيد الصوديوم في مخلوط
سنستخدم في هذه التجربة مخلوط من كربونات الصوديوم (Na2CO3)وهيدروكسيد الصوديوم (NaOH) مجهولي التركيز، توضع كمية محددة منه (10 ml) في الدورق المخروطي وتتم المعايرة بواسطة حمض الهيدروكلوريك القياسي.
(أ) عند استخدام دليل الفينولفثالين في المعايرة:
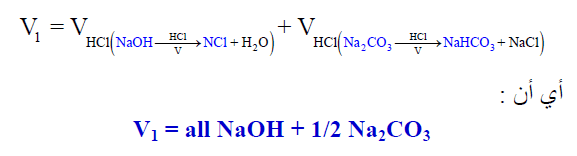
(ب) عند استخدام دليل الميثيل البرتقالي في المعايرة:


الأدوات والمواد المستخدمة فى التجربة
2- ماصة سعتھا (10 ml)
خطوات التجربة
أولاً/ إجراء التجربة باستخدام دليل الفينولفثالين :
1-اغسل السحاحة بالماء العادي ثم بالماء المقطر مرتين أو ثلاثاً ثم اغسلھا بمحلول حمض الھيدروكلوريك (HCl)
2-املأ السحاحة (مستخدماً قمع) بحمض الهيدروكلوريك (HCl)حتى يصل الحمض أعلاھا ثم افتح صمام التحكم السفلي بالسحاحة لإنزال مستوى الحمض بالسحاحة حتى العلامة صفر.
3-اغسل دورقاً مخروطياً سعته (250 ml)بالماء العادي ثم بالماء المقطر.
4-اغسل ماصة سعتھا (10 ml)بالماء المقطر ثم اغسلھا بمحلول خليط كربونات الصوديوم (Na2CO3)وهيدروكسيد الصوديوم (NaOH).
5- اسحب (10 ml)من محلول خليط كربونات الصوديوم (Na2CO3)وهيدروكسيد الصوديوم (NaOH)بالماصة ثم ضعھا بالكامل فيالدورق المخروطي . وإذا بقي شيء من المحلول في نھاية الماصة فاحرص على إنزاله في الدورق برطم نھايتھا برفق بقاع الدورق المخروطي.
6-أضف قطرتين أو ثلاثاً من دليل الفينولفثالين (ph.ph) على المحلول بالدورق المخروطي لتحصل على اللون الأحمر الوردي.
7- ابدأ المعايرة بإضافة حمض الھيدروكلوريك الموجود بالسحاحة(HCl) تدريجياً إلى محلول الخليط الموجود بالدورق المخروطي مع تحريك الدورق المخروطي باستمرار أثناء المعايرة وعند نقطة النھاية (end point – e.p) يختفي اللون الأحمر من المحلول.
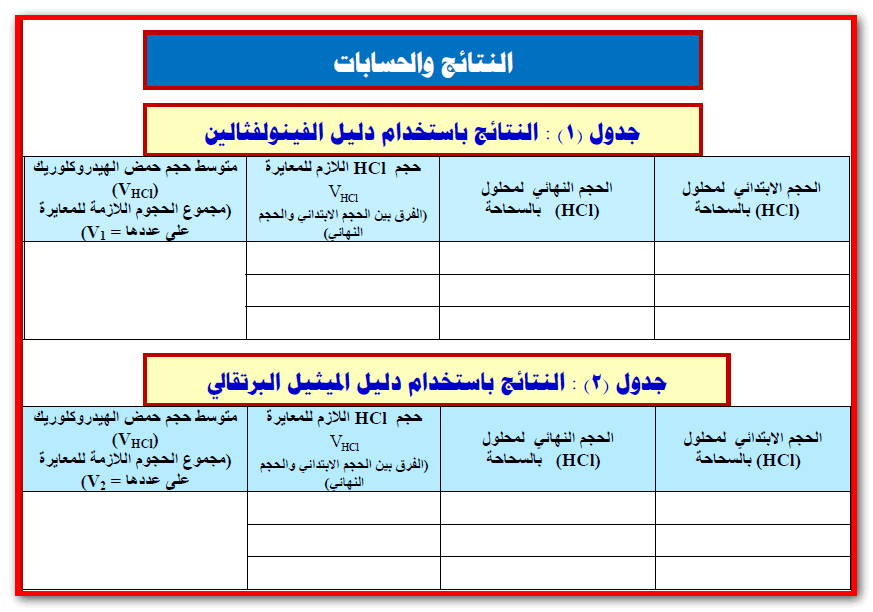
9-تخلص من المحلول الموجود في الدورق المخروطي واغسله بالماء المقطر، ثم خذ ( (10 mlجديدة من الخليط وأضف إليھا قطرتين أو ثلاثاً من دليل الفينولفثالين ثم ابدأ المعايرة من جديد حتى تصل إلى نقطة النھاية باختفاء اللون الوردي وسجل هذه القراءة.10- كرر الخطوة السابقة ( خطوة ٩) مرة ثالثة ثم سجل حجم الحمض الذي عايرت به.

ثانياً/ إجراء التجربة باستخدام دليل الميثيل البرتقالي
12- تخلص من المحلول الموجود في الدورق المخروطي واغسله بالماء المقطر. ثم خذ (10 ml) جديدة من الخليط وأضف إليھا قطرتين أو ثلاثاً من دليل الميثيل البرتقالي. ثم ابدأ المعايرة من جديد حتى تصل إلى نقطة النھاية والتي عندھا يتحول لون الدليل من اللون الأصفر البرتقالي إلى اللون الأحمر.
14-كرر الخطوة السابقة (خطوة 12) مرتين باستخدام دليل الميثيل البرتقالي. ثم خذ المتوسط الحجوم الثلاثة وارمز لھذا المتوسط بالرمز (V2) ويكون الحجم في هذه الحالة يكافئ :



تطبيقات حسابية


 تعرف على علم الكيمياء
تعرف على علم الكيمياء








احسنتم بارك الله بكم
شكراً لك يا عزيزى
احسنتم بارك الله بكم
شكراً لك أخي
شكراً لك ع الموضوع
ممكن ان تعطيني بعض الاسئلة عن هذهِ التجربة للمناقشة
expalin the effect of each of the following sources of error on the molarity of NaoH as determined in the titration experiment stating whether the concentration of NaoH abtained would be too high or too low.
a- the burette iscontaminated with an acid solution.
b_ the burette contains alarge air bubble in the the tip which disappears in the course of the titrationn
c- a small volume of the acid solution is spilled when you transfer it into the erlenmeyer flask
شكرا على مجهودكَ الجبار
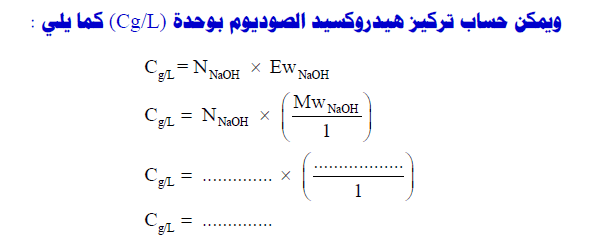
لماذا يكون تركيز هيدروكسيد الصوديوم اكبر من تركيز كاربونات الصوديوم؟ ممكن رد
ردا للأستاذ عمر شاكر بالمختصر
عند تخفيف هيدروكسيد الصوديوم باستخدام معاملات مثل CO2 والماء عند درجة حرارة من 55 الى 70 مع ضغط من 1 Kg/cm2 الى 1.6
عندها يتم انقاص تركيز اهيدروكسيد الصوديوم الى نسب متفاوته تتحكم بها بمعامل الريشيو بين الماء والكوستك وثاني اكسيد الكربون
مايعرف ب كربونات الصوديم
لماذا تم استخدام دليلين؟
ما هي النظريه حول هذا التجربه