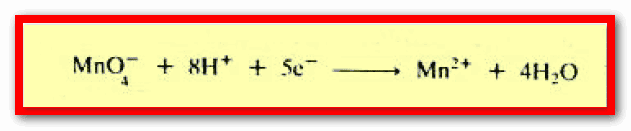– في هذا الموضوع سيتم مناقشة أنواع التفاعلات في التحليل الحجمي وذكر نبذة مختصرة عن كل نوع من الأنواع الاخرى.

محتويات الموضوع
أنواع التفاعلات فى التحليل الحجمي
– يمكن تقسيم أنواع التفاعلات المستخدمة في التحليل بالمعايرة بصورة عامة إلى قسمين رئيسين وذلك طبقاً لطبيعتها وسلوكها وهما كما يلي:
أولاً/ أنواع التفاعلات التي لا يحدث فيها تغير في التكافؤ
– هذه التفاعلات عبارة عن إتحاد أيونات مع بعضها البعض مع احتفاظ كل الأيونات الداخلة في التفاعل بتكافؤاتها دون تغيير.
– تنقسم أنواع التفاعلات التى لايحدث لها تغير فى التكافؤ إلى ثلاث أنواع كما يلي:
(1) تفاعلات التعادل Neutralization reactions
(2) تفاعلات الترسيب Precipitation Reactions
(3) تفاعلات تكوين المتراكبات Complex Formation Reactions
ثانياً/ أنواع التفاعلات التي يحدث فيها تغير في التكافؤ
– تسمي هذه التفاعلات بتفاعلات الأكسدة والاختزال (Redox Reaction) وهي التي يصاحبها تغير في التكافؤ للمواد المؤكسدة والمواد المختزلة.
– يتم خلال هذه التفاعلات انتقال الالكترونات من المواد المختزلة إلى المواد المؤكسدة.
– ينتج عن ذلك تغير في رقم الأكسدة Oxidation number لهذه المواد.
– تعرف عملية فقد الإلكترونات بالأكسدة وعملية كسب الالكترونات بالاختزال.
تفاعلات التعادل Neutralization reactions
– تسمى هذه التفاعلات أيضاً بتفاعلات الأحماض مع القواعد Acid – Base reactions
– تشتمل علي معايرات الأحماض والقواعد وفيها يستقبل أيون الهيدروجين (proton) بواسطة قاعدة (Proton Acceptor) ليكون الماء الذي يمكن اعتباره غير متأين (Undissociated) حسب التفاعل كما يلي:
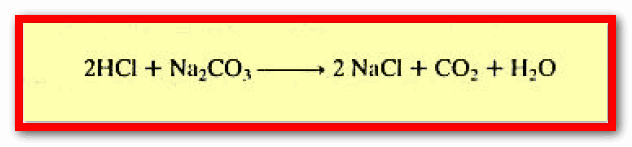
– كما تشمل أيضاً تفاعل حامض قوي مع ملح شقه الحمضي ضعيف تكون فيه الصفات القاعدية سائدة مثل تفاعل حمض الهيدروكلوريك مع كربونات الصوديوم.
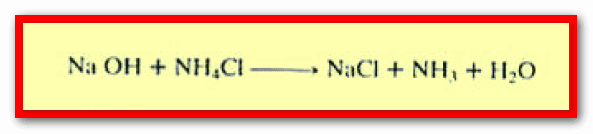
– كما تشمل تفاعل قاعدة قوية مع ملحه شقه القاعدي ضعيف تكون فيه الصفات الحمضية سائدة مثل تفاعل هيدروكسيد الصوديوم مع كلوريد الأمونيوم.
– يستفاد من التفاعلات السابقة في تقدير الأحماض والقواعد والأملاح التي يكون أحد شقيها ضعيف.
– يطلق على معايرة حمض قوي أو ملح شقه القاعدي ضعيف بقاعدة قوية بالقياس القلوي (Alkalimetry).
– أما عند معايرة قاعدة قوية أو ملح شقه الحمضي ضعيف بحامض قوي فيعرف ذلك بالقياس الحمضي (Acidimetry)
تفاعلات الترسيب Precipitation Reactions
– تفاعلات الترسيب هي أحد أنواع التفاعلات المستخدمة فى التحليل الحجمي.
– تعتمد على الاتحاد بين الأيونات أيضاً، ولكنها ليست أيونات الهيدروجين والهيدروكسيل، وينتج عن هذه التفاعلات تكون راسب شحيح الذوبان.
– فمثلاً عند تفاعل أيون الكلوريد مع أيون الفضة ينتج راسب أبيض من كلوريد الفضة كما بالتفاعل التالي:
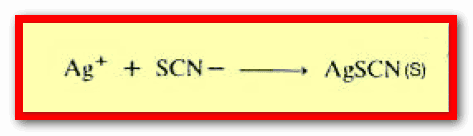
– كذلك ينتج راسب أبيض من تفاعل أيون الفضة مع أيون الثيوسيانات كما بالتفاعل التالي:
– عند استخدام الفضة كأيون مرسب كما فى التفاعلات السابقة، فإن المعايرة تعرف بالقياس الفضي (Argentometry).
تفاعلات تكوين المتراكبات Complex Formation Reactions
– تعتمد هذة التفاعلات على اتحاد الأيونات لتكون متراكباً أو أيوناً معقداً ضعيف التفكك ويمكن أن يتم كما يلي:
(1) تفاعل الأيون المراد تعيينه مع أيون آخر معروف التركيز، كما في حالة معايرة أيون السيانيد بنترات الفضة كما بالمعادلة الأتية:
(2) أو تفاعل الأيون المراد تعيينه مع جزئ ليعطي ايوناً معقداً مثل تفاعل أيون النحاس الثنائي مع الأمونيا كما بالمعادلة الأتية:
(3) أو تفاعل أيون المعدن المراد تعيينه مع مركب مخلبي مثل رباعي خلات ثنائي أمين الأثيلين (EDTA) مثل تفاعل ايون الكالسيوم مع مركب الــــ EDTA
حيث يرمز للـــ EDTA بـ H2Y-2 في المعادلات.
تفاعلات الأكسدة والاختزال Redox Reaction
– هي أحد أنواع التفاعلات المستخدمة فى التحليل الحجمي وهي التي يصاحبها تغير في التكافؤ للمواد المؤكسدة والمواد المختزلة.
– يتم خلال هذه التفاعلات انتقال الالكترونات من المواد المختزلة إلى المواد المؤكسدة.
– ينتج عن ذلك تغير في رقم الأكسدة ((Oxidation Number لهذه المواد.
– تعرف عملية فقد الإلكترونات بالأكسدة وعملية كسب الالكترونات بالاختزال.
– فمثلاً أيون الحديد الثنائي عندما يفقد إلكترونا واحداً يتأكسد إلى أيون الحديد الثلاثي كما يلي:
– عندما تختزل البرمنجنات في وسط حمضي فإنها تأخذ خمسة الكترونات، أو يحدث انتقال خمسة الكترونات إلى أيون البرمنجنات كما يلي:
– وبجمع المعادلتين السابقتين بعد مساواة عدد الإلكترونات في كلتيهما نحصل على المعادلة الآتية كما يلي:
– نلاحظ من هذه المعادلة أن خمسة أيونات من الحديد الثنائي تأكسدت بواسطة أيون واحد من البرمنجنات في وسط حمضي وخمسة الكترونات فقدت من خمس أيونات من الحديد الثنائي.
المراجع : أنواع التفاعلات في التحليل بالمعايرة Classification of Reaction in Titrimetric Analysis – الفصل الثاني (أسس التحليل بالمعايرة) من كتاب التحليل الكيميائي الكمي التقليدي لطلاب الكليات والجامعات من تأليف : أ.د/محمد أحمد آشي ، أ.د/ عبد الغني حمزة ، د/ توفيق عميرة ، د/ عبد العزيز السباعي ، د/ أحمد عشي.
 تعرف على علم الكيمياء
تعرف على علم الكيمياء