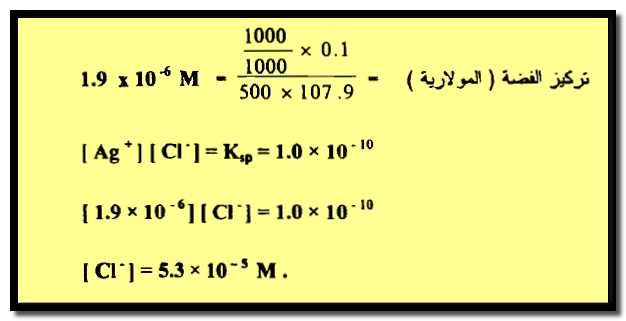الترسيب وحاصل الإذابة + مسائل محلولة
محتويات الموضوع
تطبيقات حاصل الإذابة على عملية الترسيب
– من أهم تطبيقات حاصل الإذابة على عملية الترسيب كما يلي:
(1) الترسيب
(2) ذوبان الراسب
(3) منع عملية الترسيب.
– وسيتم مناقشة كلاً منهما على حدا للتوضيح مع المسائل المحلولة.
(1) الترسيب
– يفيد حاصل الإذابة في تفاعلات الترسيب.
– فعندما تزيد قيمة حاصل ضرب الأسس المخصصة لتركيزات أي نوعين من الأيونات في المحلول عن قيمة حاصل الإذابة المناظر يترسب الأيون الموجب والأيون السالب نتيجة لإتحادهما حتى يصبح حاصل ضرب تركيز هذين النوعين من الأيونات المتبقية فى المحلول (مرفوعاً إلى الأس المناسب له) مساوياً لقيمة حاصل الإذابة.
مثال للتوضيح
– عندما يُضاف بعض من فلوريد الصوديوم NaF إلى محلول مشبع من فلوريد الكالسيوم CaF2 فإن [F–] تزيد كثيراً وبذلك يزداد قيمة حاصل ضرب درجة تركيز الأيونات زيادة مؤقتة عن قيمة حاصل الإذابة.
– للمحافظة على حالة الاتزان يتحد بعض منCa2+ مع كمية مكافئة منF– ليتكونCaF2 الصلب إلى أن يصبح حاصل ضرب تركيزات الأيونات المتبقية في المحلول [Ca2+] × [ F–]2 مساوياً مرة أخري لحاصل الإذابة.
– يجب أن نلاحظ في هذه الحالة أن القيمة النهائية لتركيز أيون الفلوريد [F–] أكبر بكثير من ضعف قيمة [Ca2+] لأن فلوريد الصوديوم يساهم بكمية كبيرة من قيمة [F–] الكلية.
(2) ذوبان الرواسب
– حينما يكون حاصل ضرب تركيز أى أيونين (مرفوعاً على الأس المناسب) في محلول اقل من حاصل الإذابة المناظر، فإن المحلول لا يكون مشبعاً.
– إذا أضيفت بعض من الأملاح الصلبة المناظرة إلى المحلول لا يكون مشبعاً.
– إذا أضيفت بعض من الأملاح الصلبة المناظرة إلى المحلول فإن كمية أكبر من الملح تذوب.
مثال للتوضيح
– إذا أضيف حمض الهيدروكلوريك (مصدر الحصول على H+) إلى محلول من هيدروكسيد الماغنسيوم فإن أيون الهيدروجينH+ يتفاعل تقريباً مع كل أيونات OH– لتكوين الماء حيث يقل تركيز أيونات الهيدروكسيل في المحلول.
– ويؤدي هذا إلى ذوبان كمية أكبر من Mg(OH)2 بحيث يصبح حاصل ضرب التركيزات مساوياً مرة أخري إذابة Mg(OH)2.
(3) منع عملية الترسيب
– لمنع عملية ترسيب ملح شحيح الذوبان فإنه يلزم إضافة قليل من مادة تساعد على خفض تركيز أحد الأيونات بحيث لا يمكن الوصول إلى قيمة حاصل الإذابة للملح شحيح الذوبان.
مثال للتوضيح
– لا تؤدي إضافةH2S إلى ترسيب FeS من محلول حمض قوي (HCl) يحتوي على أيونات Fe+2
– وذلك لأن كميةH+ الناتجة من حمض الهيدروكلوريك تمنع تأين H2S (نتيجة تأثير الأيون المشترك) وبذلك تقلل من [S2-]إلى درجة لا تسمح بالوصول إلى قيمة حاصل إذابة FeS.
مسائل محلولة على عملية الترسيب وحاصل الإذابة
مثال (1): أحسب حاصل الإذابة لكرومات الفضة AgCrO4 (الوزن الجزيئي هو 332) إذا علمت أن ذوبانيتها هي 0.022 جم / لتر؟
الحل:
تكون الإجابة كما يلي:
مثال (2): تترسب الفضة في محلول بإضافة أيون الكلوريد في محلول حجمه 500 سم3 . ما هو تركيز ايون الكلوريد إذا لم يبق أكثر من 0.1 ملجم من الفضة غير مترسب؟
الحل:
تكون الإجابة كما يلي:
مثال (3): احسب كمية الإذابة بالجم / لتر لهيدروكسيد الرصاص Pb(OH)2 . إذا علمت أن حاصل الإذابة لــــ Pb(OH)2 هي 2.5 × 10-16؟
الحل:
تكون الإجابة كما يلي:
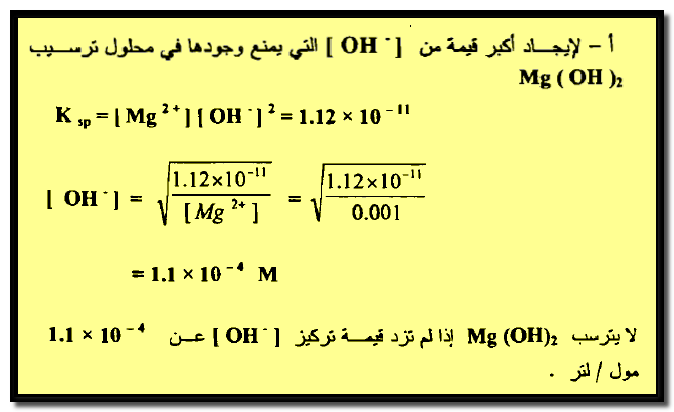
مثال (4): أحسب تركيز أيون الأمونيومNH4+ الناتج عن NH4Cl اللازم لمنع Mg(OH)2 من الترسيب في لتر من محلول يحتوي علي0.01 مول من الأمونيا و0.01 مول من Mg+2 مع العلم أن ثابت التأين للأمونيا 1.8 × 10-5 وحاصل إذابةMg(OH)2 يساوي 1.12 × 10-11 ؟
الحل:
تكون الإجابة كما يلي:
المراجع : تطبيقات حاصل الإذابة على عملية الترسيب – الباب الثالث / الإذابة وحاصل الإذابة Solubility and solubility product. من كتاب أسس الكيمياء التحليلية (التحليل الوصفي والكمي والآلي ) للمؤلف / محمد مجدي عبدالله واصل.