في هذه التجربة سيتم تعيين تركيز حمض الھيدروكلوريك (HCl) باستخدام محلول قياسي من Na2CO3 بواسطة دليل الفينولفثالين ودليل الميثيل البرتقالي.

نظرية تجربة تعيين تركيز حمض الھيدروكلوريك (HCl) باستخدام محلول قياسي من Na2CO3
يتفاعل حمض الهيدروكلوريك (HCl) مع كربونات الصوديوم (Na2CO3) كما يلي:
وھذا يدل على أن مولين من (HCl) قد تفاعلا مع مول واحد من (Na2CO3) لإنتاج المواد وفق المعادلة السابقة.
ولكن ھل تؤدي إضافة مول واحد من (HCl) إلى مول واحد من (Na2CO3) إلى تفاعل ھذا المول من (HCl) مع نصف مول فقط من (Na2CO3) لإعطاء المواد الناتجة حسب المعادلة السابقة مع بقاء نصف مول من (Na2CO3) بحالة غير متفاعلة ؟
الإجابة :لا والسبب أن تكوين المواد الناتجة أعلاه يحصل على مرحلتين:
المرحلة الأولى:
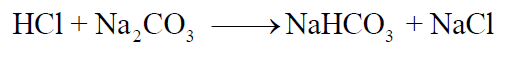
أي أن جميع الكربونات تتحول أولاً إلى بيكربونات.
المرحلة الثانية:
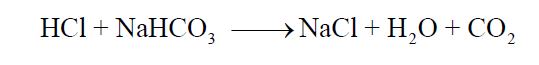
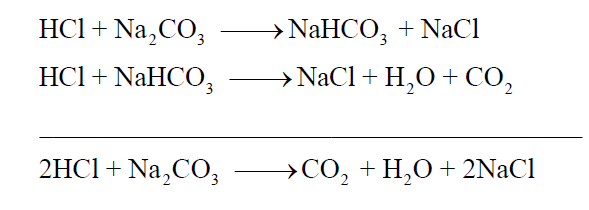
وجد أن الاستهلاك الكامل للكربونات وتحويلها إلى بيكربونات تكون قيمة الأس الهيدروجيني pH لمحلول التفاعل تساوي (8.3). وباستمرار إضافة حمض الهيدروكلوريك HCl يشرع التفاعل الثاني في الحدوث. فإنه بإتمام هذا التفاعل أي استهلاك كامل للبيكربونات التي تكونت نتيجة التفاعل الأول. تكون قيمة الأس الهيدروجيني لمحلول التفاعل تساوي (3.8). وهـما المدى للأس الهيدروجيني الذي يتغـير فيه لون كل دليـل الفينولفثالين (8 – 10) ودليل الميثيل البرتقالي (3.1 – 4).
الأدوات والمواد المستخدمة في تجربة تعيين تركيز حمض الھيدروكلوريك (HCl) باستخدام Na2CO3
1- دورق مخروطي سعته (250ml)
2- ماصة سعتھا(10ml)
3- سحاحة سعتھا (50ml)
4- حمض الكلور (HCl) المجهول التركيز.
5- محلول كربونات الصوديوم (Na2CO3) معلوم التركيز (0.1M) .
6- كأسين سعة (100ml) أحدهما للحمض والآخر للقاعدة.
7- قارورة غسيل بلاستيكية تملأ بالماء المقطر.
8- دليل الفينولفثالين – دليل الميثيل البرتقالي
أولاً/ إجراء تجربة تعيين تركيز حمض الھيدروكلوريك (HCl) باستخدام دليل الفينول فثالين
(1) اغسل السحاحة بالماء العادي ثم بالماء المقطر مرتين أو ثلاثاً.
(2) أملأ السحاحة مستخدماً قمع بمحلول حمض الهيدروكلوريك مجهول التركيز حتى يصل الحمض أعلاھا ثم افتح صمام التحكم السفلي بالسحاحة لإنزال مستوى القاعدة بالسحاحة حتى العلامة صفر.
(3) اغسل دورقاً مخروطياً سعته (250ml) بالماء العادي ثم بالماء المقطر.
(4) اغسل ماصة سعتھا (10ml) بالماء المقطر ثم بمحلول كربونات الصوديوم.
(5) اسحب (10ml) من محلول كربونات الصوديوم بالماصة ثم ضعھا بالكامل في الدورق المخروطي. وإذا بقي شيء من المحلول في نهاية الماصة فاحرص على إنزاله في الدورق برطم نھايتھا برفق بقاع الدورق المخروطي .
(6) أضف قطرتين أو ثلاثاً من دليل الفينولفثالين إلى محلول كربونات الصوديوم بالدورق المخروطي فيصبح لونه أحمر وردي.
(7) ابدأ المعايرة بإضافة محلول حمض الهيدروكلوريك الموجود بالسحاحة تدريجياً إلى محلول كربونات الصوديوم الموجود بالدورق المخروطي مع رج الدورق المخروطي باستمرار أثناء المعايرة.
وعند نقطة النھاية (end point –e.p ) والتي فيھا تتحول جميع كربونات الصوديوم إلى بيكربونات الصوديوم يصبح دليل الفينولفثالين عديم اللون. وتكون معادلة التفاعل ھي :
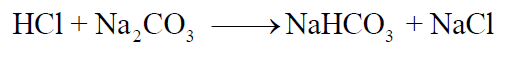
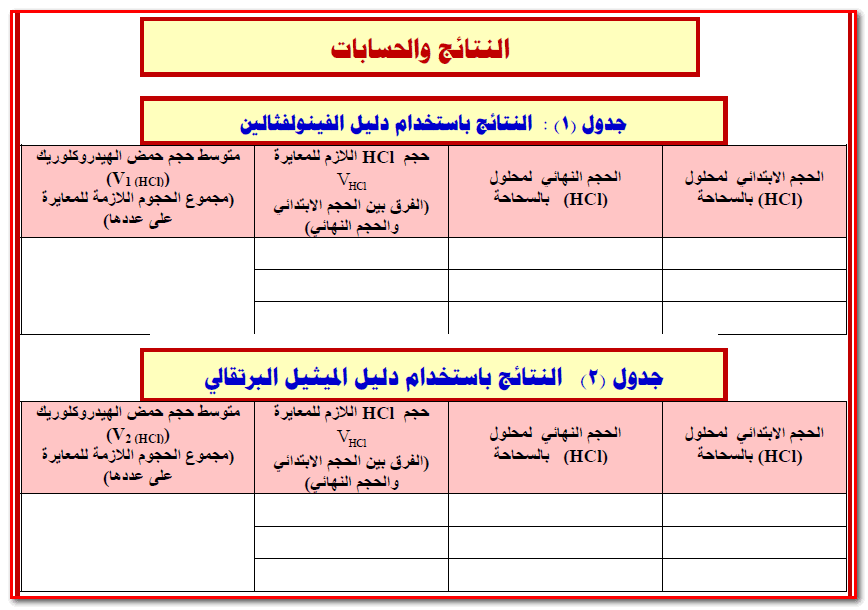
(8) سجل حجم محلول حمض الهيدروكلوريك الذي عايرت به والذي كان لازماً لتحويل لون دليل الفينولفثالين من الأحمر الوردي إلى عديم اللون ( الحجم الذي حصلت عليه من الفقرة 7 السابقة ).
(9) تخلص من المحلول الموجود في الدورق المخروطي واغسله بالماء المقطر، ثم خذ (10ml) جديدة من القاعدة (كربونات الصوديوم ) وأضف إليها قطرتين أو ثلاثاً من دليل الفينولفثالين ثم ابدأ المعايرة من جديد حتى تصل إلى نقطة النهاية ( بتغير لون الدليل من الأحمر الوردي إلى عديم اللون ) وسجل حجم الحمض.
إيجاد متوسط حجم الحمض
(10) كرر الخطوات السابقة ( خطوة 9 ) مرة ثالثة ثم سجل حجم الحمض الذي عايرت به .
(11) قم بإيجاد متوسط حجم الحمض الذي عايرت به في الفقرات ( 7، 9 ، 10) وذلك بجمعه ثم قسمته على 3 وسجل هذه النتيجة في الجدول رقم (1) ، وارمز لمتوسط الحجم في ھذه الحالة بالرمز V1 حيث أنه حجم الحمض اللازم لإتمام المرحلة الأولى من التفاعل وبالتالي فإن:
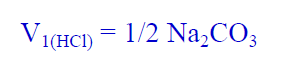
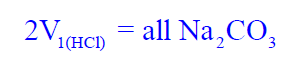
ثانياً/ إجراء تجربة تعيين تركيز حمض الھيدروكلوريك (HCl) باستخدام دليل الميثيل البرتقالي
(12) تخلص من المحلول الموجود في الدورق المخروطي واغسله بالماء المقطر ثم خذ (10ml) جديدة من القاعدة (كربونات الصوديوم) وأضف إليھا قطرتين أو ثلاثاً من دليل الميثيل البرتقالي لتحصل على اللون الأصفر البرتقالي.
(13) ابدأ المعايرة بإضافة حمض الھيدروكلوريك الموجود بالسحاحة تدريجياً إلى محلول كربونات الصوديوم الموجود بالدورق المخروطي مع تحريك الدورق المخروطي باستمرار أثناء المعايرة .
وعند نقطة النھاية ( end point ) يتحول لون الدليل إلى اللون الأحمر. وعندھا يكون جميع كربونات الصوديوم في الدورق المخروطي قد تفاعلت مع الحمض وفقاً للمعادلة التالية :
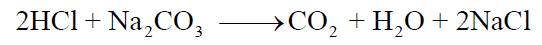
(14) سجل في جدول (2) بقسم النتائج حجم محلول حمض الذي عايرت به ( والذي حصلت علية من الفقرة 13 السابقة ) والذي كان لازماً لتحويل لون دليل الميثيل البرتقالي إلى اللون الأحمر .
(15) تخلص من المحلول الموجود في الدورق المخروطي واغسله بالماء المقطر، ثم خذ (10ml) جديدة من القاعدة (كربونات الصوديوم) وأضف إليھا قطرتين أو ثلاثاً من دليل الميثيل البرتقالي ثم ابدأ المعايرة من جديد حتى تصل إلى نقطة النھاية وسجل ھذه القراءة.
(16) كرر الخطوة السابقة ( خطوة 15 ) مرة ثالثة ثم سجل حجم الحمض الذي عايرت به.
(17) قم بجمع حجوم حمض الكلور التي حصلت عليھا في الفقرات ( 14 ،15، 16) ثم اقسمھا على (3) لتحصل على متوسط هذه الحجوم وسجل ھذا المتوسط بالجدول رقم (2) وارمز له بالرمز V2 حيث أن :
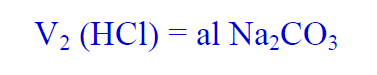


 تعرف على علم الكيمياء
تعرف على علم الكيمياء






احسب كتله كربونات الصوديوم اللامائيه التي يجب اذابتها في 250 جرام من الماء لكي يتعادل 15 مول/لتر منها مع 15 مول/لتر من حمض الهيدروكلوريك الذي تركيزه ٠,٢ مول/لتر
ممتاز
لماذا لا يمكن تحضير المحلول القياسي الاولي لحامض الخليك بطريقة مباشرة بتخفيف حجوم مركزة
لماذا نستخدم دليل مثيل البرتقال مع هذه المعايرة
اذا استخدم نفس الحجوم ولكن عكس الوضع اي ان الكربونات في السحاحة والحمض في الدورق فلماذا يحدث التعادل قبل استخدام حجم الكربونات بالكامل
لماذا يستخدم دليل المثيل البرتقالي في التجربه
اريد مناقشه التجربه اذا امكن
مجهود مشكور