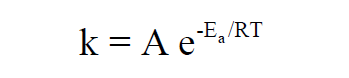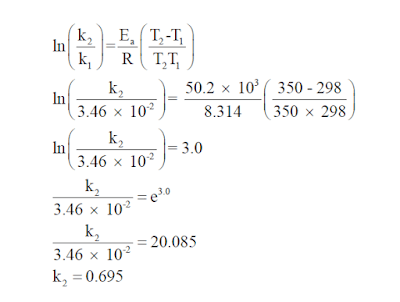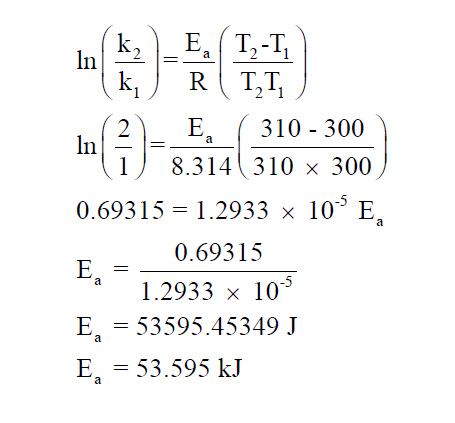– في هذا الموضوع سيتم مناقشة معادلة أرهينيوس The Arrhenius Equation والصيغة الرياضية لها مع الأمثلة والتمارين للتوضيح.
محتويات الموضوع
معادلة أرهينيوس The Arrhenius Equation
– استطاع العالم أرهينيوس عام 1889 م التوصل إلى علاقة رياضية هامة يمكن بواسطتها حساب أو معرفة الأثر الكمي لدرجة الحرارة على سرعة التفاعل الكيميائي وتعرف هذة المعادلة الآن بمعادلة أرهينيوس.
– ويعبر عنها بالصيغة الرياضية الآتية كما يلي:
– وتصبح المعادلة بعد أخذ اللوغاريتم الطبيعي (ln) لكلا الطرفين كما يلي:
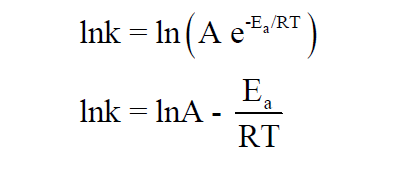
حيث:
(Ea) = طاقة التنشيط.
(R) = الثابت العام للغازات = (R = 8.314 J/mol K).
(T) = درجة الحرارة المطلقة.
(A) = يمثل تردد التصادم (collision frequency) ويسمى بمعامل التردد (frequency factor) ويمكن أن يعامل كثابت لتفاعل معين في نطاق واسع نسبياً من درجة الحرارة.
– ويلاحظ من المعادلة السابقة أن ثابت سرعة التفاعل K:
- يتناسب طردياً مع (A) أي مع تردد التصادم.
- يتناقص مع زيادة طاقة التنشيط.
- يزداد مع زيادة درجة الحرارة.
– الخلاصة: سرعة التفاعلات تتناقص كلما كان حاجز الطاقة كبيراً وتزداد مع زيادة درجة الحرارة.
الرسم البياني لمعادلة أرهينيوس
– من الصيغة الرياضية لمعادلة ارهينيوس كما يلي:
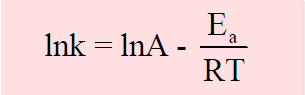
– هذه المعادلة هى معادلة خط مستقيم (y = a x + b) حيث يمكن أن تصاغ بالصورة الآتية كما يلي:
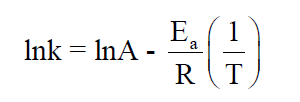
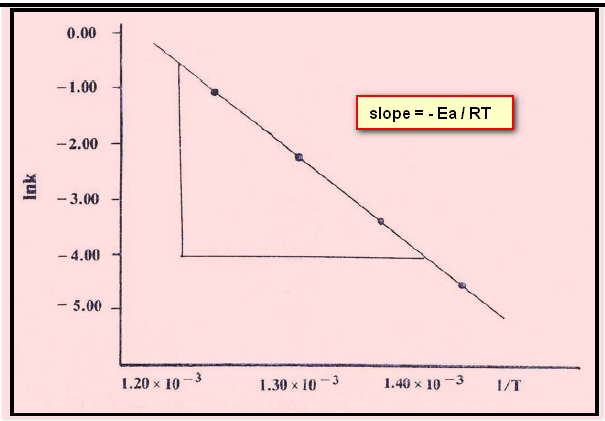
– (ln k) يرسم على محور الصادات و يمثل (I/T) على محور السينات ، فنحصل على خط مستقيم ميله (Ea / RT-) والجزء المقطوع من محور الصادات يمثله (ln A) ومنه يمكن حساب الثابت (A) كما يلي:
معادلة أرهينيوس عند درجتي حرارة مختلفتين
– عند درجتي حرارة مختلفتين (T1, T2) نحصل على ثابتي سرعة مختلفين (k1, k2)
– وبتمثيل ھذه القيم في معادلة أرھينيوس كما يلي:

مسائل محلولة على معادلة أرهينيوس
سؤال (1):
إذا كان لديك تفاعلاً من الرتبة الأولى ، وكان ثابت سرعة التفاعل عند درجة حرارة (298K) يساوي (k1 = 3.46 × 10-2 s-1)
أحسب قيمة ثابت سرعة التفاعل k2 عند درجة حرارة (350K) إذا علمت أن طاقة التنشيط تساوي (Ea =50.2kJ/mol) ؟
الحل:
تكون طريقة حل المسألة كما يلي:
سؤال (1):
أحسب قيمة طاقة التنشيط إذا تضاعفت قيمة ثابت سرعة تفاعل ما عندما ترتفع درجة من (27ºC) إلي (37ºC)؟
الحل:
تكون طريقة حل المسألة كما يلي:
المراجع : الفصل الأول ” التفاعل الكيميائي والعوامل المؤثرة عليه ” من كتاب الكيمياء الحركية والحفز Kinetic Chemistry للدكتور / عمر بن عبد الله الهزازي
 تعرف على علم الكيمياء
تعرف على علم الكيمياء