القانون الأول للديناميكا الحرارية – القانون الأول في الثیرمودینامیك
– في هذا الموضوع سيتم مناقشة وشرح القانون الأول للديناميكا الحرارية – القانون الأول في الثیرمودینامیك First Law of Thermodynamics بالتفصيل
محتويات الموضوع
نص القانون الأول للديناميكا الحرارية
– القانون الأول للديناميكا الحرارية (القانون الأول في الثیرمودینامیك) مرادف لقانون حفظ الطاقة.
– وینص على أن:
(الطاقة لا تفنى ولا تستحدث (تخلق من عدم) ولكن یمكن فقط نقلھا من مكان الى آخرأو تحویلھا من شكل الى آخر أثناء التفاعلات أو التغیرات الكیمیائیة).
شرح القانون الأول للديناميكا الحرارية
– بمعنى أن طاقة النظام المعزول عن محیطه تظل ثابتة .
– وبالتالي یمكن صیاغة القانون الأول للدینامیكا الحراریة كما یلي:
(الطاقة الكلیة لنظام معزول تظل ثابتة ویمكن تحول الطاقة من صورة الى أخرى)
– وھذا یعني أن مجموع كل أنواع الطاقات ثابت في أي مجموعة معزولة.
– ومن ذلك یأتي القول المعروف والقائل بأن طاقة الكون ثابتة، على أساس أن الكون یعتبر نظاماً معزولاً.
– أكبر الأثر في دعم ھذا – كان للتجارب التي أجراھا جیمس جول ، حیث أثبت بتجاربه أن الحرارة والشغل المیكانیكي ھما وجھان لعملة واحدة وھي الطاقة، وأنه یمكن تحویل صور الطاقة إلى بعضھا البعض، وأن الطاقة لا تفنى.
تجربة لإثبات أن الطاقة لا تفنى ولا تخلق من عدم
– والتجارب التي تثبت أن الطاقة لا تفنى ولا تخلق من عدم ، ولكنھا تتحول من صورة الى أخرى كثیرة، ومنھا التجربة الآتية كما يلي:
– عند بذل قدر من الطاقة في ضغط لولب من الصلب، ثم إذابتة وھومضغوط في حمض.
– فقد یبدو أن الطاقة التي بذلت في ضغط اللولب قد فقدت ولكن في الحقیقة إنھا اختزلت باللولب.
– ویؤكد ذلك أن كمیة الحرارة التي تنتج من ذوبان اللولب المضغوط، تكون أكبر من تلك التي تنتج عن ذوبان اللولب نفسة وھو غیر مضغوط.
– والفرق بین القیمتین یساوي مقدار الشغل المبذول في ضغط اللولب (في ھذه الحالة نجدأن الشغل قد تحول الى حرارة).
الصياغة الرياضية للقانون
– يمكن التعبير عن القانون الأول للديناميكا الحرارية بالصيغة الرياضية الآتية كما يلي:
ΔE = q + w
حيث أن:
ΔE = مقدار التغیر في الطاقة الداخلیة للنظام.
q = كمیة الحرارة الممتصة أو المنبعثة بواسطة النظام.
W = الشغل المبذول على أو بواسطة النظام.
ملاحظات هامة القانون الأول للديناميكا الحرارية
– بعض المراجع تكتب القانون الأول في الثیرمودینامیك ریاضیاً على الصورة ΔE = q + w بدلاً من الصورة ΔE = q – w وكلاهما صحیح لأن كلاً منھم أعطى الشغل المبذول على النظام أو المبذول بواسطة النظام إشارة مخالفة.
– ففي القانون إذا كان الشغل المبذول بواسطة النظام تكون إشارته موجبة.
– أما إذا كان الشغل مبذولاً على النظام تكون إشارته سالبة.
– في المسائل الحسابية سنعتمد العلاقة: ΔE = q + w
– الجدول التالي يشرح ملخص لإشارة الشغل وكمیة الحرارة كما يلي:
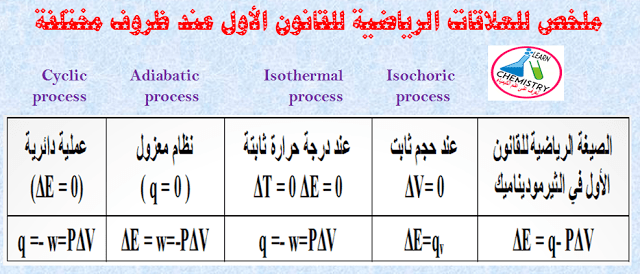
– الجدول التالي يوضح ملخص للقانون الأول للديناميكا الحرارية عند ظروف مختلفة (عمليات الديناميكا الحرارية) كما يلي: