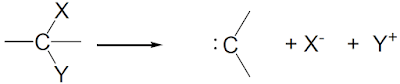قبل أن نشرح هذا الدرس المهم يجب علينا أن نتذكر بعض المفاهيم الأساسية حول الرابطة التساهمية حتى نفهم الموضوع.
تعريف الرابطة التساهمية
– تتكون الرابطة التساهمية نتيجة مشاركة كل ذرة من الذرات بعدد من الإلكترونات يساوى العدد الذي تحتاجه لكي تكمل مستوى الطاقة الأخير بالإلكترونات ويصل كل منهم بالتركيب الإلكتروني لأقرب غاز خامل.
الرابطة التساهمية النقية
– تتكون بين الذرات المتساوية في السالبية الكهربية (بين ذرات العنصر الواحد)
– يكون الفرق في السالبية الكهربية بين الذرات التي تكون الرابطة التساهميـة النقية = صفر
– تكون قدرة كل من الذرتين على جذب إلكترونات الرابطة ناحيتها متساوية وبذلك تقضى إلكترونات الرابطة في حوزة كل من الذرتين فترة متساوية وتكون شحنة كل منهم = صفر
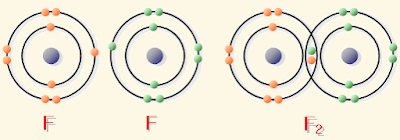
– علل: الرابطة في جزيء الفلور تساهمية نقية لأن الفرق في السالبية الكهربية بين ذرتي الفلور = صفر
أمثلة على الرابطة التساهميـة النقية
– من الأمثلة على الرابطة التساهميـة النقية كما يلي:
- جزيء الأكسجين
- جزيء الكلور
- وجزيء النتروجين
- جزيء الهيدروجين
- جزيء الفلور
- وجزيء البروم
الرابطة التساهمية القطبية
– تتكون بين ذرتين الفرق في السالبية الكهربية بينهم أقل من (1.7) (غير متساويتين في السالبية الكهربية).
– تتكون الرابطة التساهميـة القطبية بين ذرتين من عناصر المجموعة 4A) , (5A) , (6A) , (7A)) وبعضها أو مع عنصر من عناصر هذه المجموعات والهيدروجين أو عنصر من عناصر هذه المجموعات وعنصر من عناصر المجموعة (3A)
– تكون قدرة الذرة الأكثر سالبية على جذب إلكترونات الرابطة ناحيتها أكبر من الذرة الأقل سالبية نتيجة لذلك تقضى إلكترونات الرابطة:
- في حيازة الذرة الأكثر سالبية مدة أطول وتحمل شحنة جزئية سالبة (-δ)
- فى حيازة الذرة الأقل سالبية مدة أقل وتحمل شحنة جزئية موجبة (+δ)
أمثلة على الرابطة التساهميـة القطبية
– من الأمثلة على الرابطة التساهميـة القطبية كما يلي:
- النشادر
- الماء
- فلوريد الهيدروجين
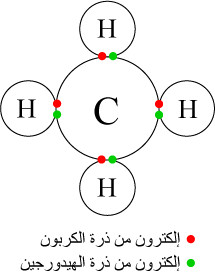
- الميثان
والآن نأتى إلى موضوع اليوم وهو إنشطار الرابطة التساهمية فلنبدأ بإذن الله
انشطار الرابطة التساهمية
تنشطر الرابطة التساهمية فى التفاعلات الكيميائية لتكوين روابط جديدة مكونة بذلك النواتج ويكون هذا الإنشطار أما متجانس أو غير متجانس كما يلي:
الإنشطار المتجانس Homolytic cleavage
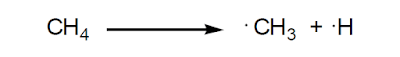
– يحدث عندما تنشطر الرابطة التساهمية بحيث يحتفظ كل جزء ناتج بإالكترون من إلكترونات الرابطة ويسمى بالجذر الحر Free radical
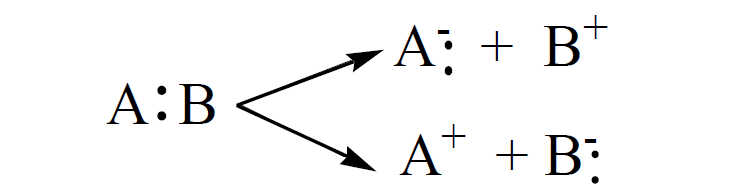
الإنشطار الغير المتجانس Heterolytic cleavage
– يحدث عندما تنشطر الرابطة التساهميـة بحيث يحتفظ أحد الجزئين الناتجين بإلكتروني الرابطة ويسمي كل جزء بالأيون Ion
الوسيطات النشطة Reactive intermediates
في التفاعلات الكيميائية التي تتم على عدة خطوات تتكون وسيطات نشطة نتيجة لإنشطار الروابط التساهمية كما يلي:
(1) الجذر الكربوني الحر Free radical
– فقير للإلكترونات فهو يحتوي علي سبعة إلكترونات فى غلاف التكافؤ لذا يتفاعل كإلكتروفيل Electrophile أى الباحث عن الألكترونات.
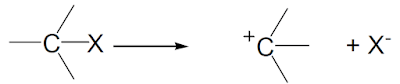
(2) الكاتيون الكربوني Carbocation
– هو الأسم الأحدث لأيون الكربونيوم Carbonium وهو أيضاً فقير للألكترونات حيث يحتوي ستة إلكترونات فقط فى غلاف التكافؤ ويتفاعل كإلكتروفيل.
(3) الأنيون الكربوني Carbocation
– غني بالإلكترونات فهو قادر على منح زوج من الألكترونات لذلك يتفاعل كنيوكلوفيل Nucleophile أى الباحث عن الشحنة الموجبة.

(4) الكربين Carbene
– ينشأ نتيجة الإنشطار غير المتجانس لرابطتين على نفس ذرة الكربون ويحتوي على ستة إلكترونات فى غلاف التكافؤ.
ملاحظات هامة:
(1) فى الكاتيونات الكربونية كلما كانت الشحنة منتشرة أو غير متمركزة delocalized تكون أكثر ثباتاً.
– وبما أن مجموعات الألكيل دافعة للألكترونات electron releasing فهى تعمل على إزاحة الكثافة الألكترونية نحو الشحنة الموجبة وبالتالي تقلل من تركيزها وتساهم بذلك فى تثبيت الكاتيون الكربوني بإكتسابها جزء من الشحنة الموجبة.
(2) ثبات الجذر الحر يماثل تقريباً ثبات الكاتيون الكربونى.
 تعرف على علم الكيمياء
تعرف على علم الكيمياء