
قانون دالتون للضغوط الجزئية
كان من الاھتمامات الرئیسية للعالم دالتون دراسة الظروف المناخیة والجویة . ولقد احتفظ لمدة ٥٧ عاماً بكتیب خاص دون فیه “ملاحظات على الطقس “ووصف فیه بعض الأجھزة المستعملة في قیاس الظروف المناخیة، كمقیاس درجة الحرارة، ومقیاس الضغط الجوي، ومقیاس درجة تشبع الھواء ببخار الماء الجوي.
وقد أدت دراسته لتركیب الھواء الجوي إلى وضع النظریة الذریة .كما أن دراسته لتغیر ضغط بخار الماء في الجو أدت إلى اكتشافه لعلاقة أولیة بسیطة تتضمن الضغط الكلي لخلیط غازي. فقد وجد أن “درجة تشبع الھواء الجوي ببخار الماء تعتمد فقط على درجة الحرارة” . فعند درجة (25Co) يكون أعلى
ضغط يحصل عليه بخار الماء هو 24
mmHg
، وهذا يعني أنه إذا سمح للماء أن يتبخر داخل وعاء مغلق، فإن ضغط بخار الماء يصل
إلى حد أقصى مقداره 24
mmHg عند درجة حرارة 25Co. وبذلك إذا
كان الهواء موجوداً داخل الوعاء وضغطه يساوي 760 mmHg فإن الضغط الكلي داخل الوعاء.
ضغط يحصل عليه بخار الماء هو 24
mmHg
، وهذا يعني أنه إذا سمح للماء أن يتبخر داخل وعاء مغلق، فإن ضغط بخار الماء يصل
إلى حد أقصى مقداره 24
mmHg عند درجة حرارة 25Co. وبذلك إذا
كان الهواء موجوداً داخل الوعاء وضغطه يساوي 760 mmHg فإن الضغط الكلي داخل الوعاء.
Pt = Pair + PH2O
Pt = 760 + 24 = 784 mmHg
أما إذا كان الوعاء مفرغاً من الھواء وضغطه = صفراً، فإن الضغط الكلي في هذه الحالة یساوي ضغط بخار الماء 24
mmHg
mmHg
وقد أجرى دالتون التجربة باستعمال غازات أخرى وحصل على نفس النتیجة. فمثلاً إذا احتوى الإناء على غاز النیتروجین N2 وضغطه 500
mmHg
ففي وجود الماء يرتفع الضغط إلى 524
mmHg
عند درجة 25
Co
mmHg
ففي وجود الماء يرتفع الضغط إلى 524
mmHg
عند درجة 25
Co
وعلى أساس هذه الدراسات فقد استنتج دالتون عام 1801 أن:
“الضغط الكلي لخلیط من الغازات لا تتفاعل مع بعضھا یساوي مجموع الضغوط الجزئیة لھذه الغازات إذا شغل كل غاز الحیز بمفرده”.
وھذا یعني أن الضغط الجزئي الناتج من غاز موجود مع مجموعة من الغازات دون أن تتفاعل كیمیائیاً یساوي ضغط الغاز بمفرده. وبذلك سوف نتعامل مع كل غاز في مزیج من الغازات كما لو كان ھو الغاز الوحید الموجود.
إن المسافات الكبیرة التي تفصل بین جزیئات الغاز كفیلة بأن تضمن لكل غاز استقلالاً عن غیره في الخلیط، وحریة في حركة جزیئاته. وعلى ھذا الأساس نتوقع أن یؤثر كل من الغازات بضغط خاص به، وكأنه الوحید الذي یشغل الحجم المحدد، وأن یكون الضغط الكلي للمخلوط مجموع هذه الضغوط الجزئیة للغازات المكونة له.


مثال
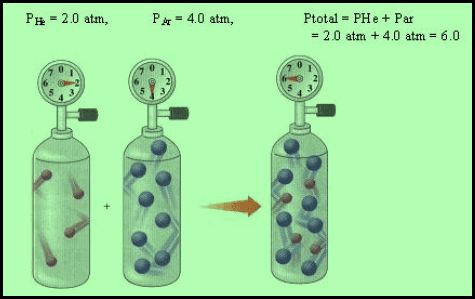
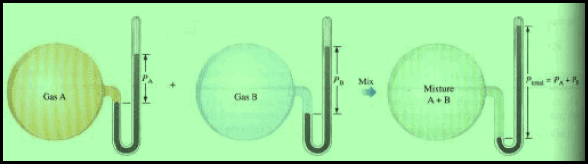
مثال
توضيحي:
فلنأخذ
مثلاً ثلاثة أوعية مليئة بغازات، سعة كل منها 1 L ، وعند نفس درجة الحرارة:
مثلاً ثلاثة أوعية مليئة بغازات، سعة كل منها 1 L ، وعند نفس درجة الحرارة:
أحدها يحتوي على غاز النيتروجين (N2) عند ضغط 0.5 atm
والثاني يحتوي على غاز الأكسجين (O2) عند ضغط 0.75 atm
والثالث يحتوي على غاز الهيدروجين (H2) عند ضغط 0.1 atm
فإذا اختلطت هذه الغازات في إناء واحد، سعته لتر واحد، فإن الضغط الكلي (Pt) یساوي مجموع ضغوط ھذه الغازات منفصلة عند نفس الدرجة والحجم:
Pt = PN2 + PO2
+ PH2
+ PH2
Pt = 0.5 + 0.75 + 0.1 = 1.35
ویعرف ضغط غاز بذاته في خلیط من الغازات بالضغط الجزئي، وبالاستعانة بالشكل التالي حیث تكون كل الأوعیة من نفس الحجم وكل منھا له مانومتر لقیاس الضغط .
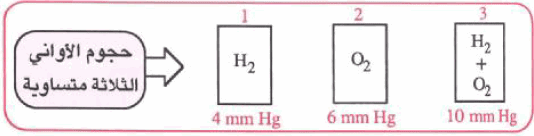
ولنفترض أن عینة من الھیدروجین قد ضخت داخل الوعاء الأول، وأن ضغطھا المقيس هو (4 mmHg) وأن عینة من الأكسجین قد ضخت في الوعاء الثاني، وأن ضغطھا المقیس ھو ((6 mmHg وإذا نقلت كلتا العینتین إلى الوعاء الثالث فإنھ یلاحظ أن الضغط یكون (10 mmHg) وبذلك فإنه یمكن صیاغة قانون دالتون للضغوط الجزئیة.
نص
قانون دالتون للضغوط الجزئية
مما سبق فإنه يمكن صياغة قانون دالتون للضغوط الجزئية
على النحو التالي:
على النحو التالي:
“الضغط الكلي لخلیط من الغازات لا تتفاعل مع بعضھا البعض في حجم معین وعند درجة حرارة معینة یساوي مجموع الضغوط الجزئیة لھذه الغازات”.
ویعبر عنه ریاضیاً في حالة خلیط یحتوي على عدد (n) من الغازات:
Pt = P1 + P2
+ ……… + Pn
+ ……… + Pn
وھذا یعني أنه عند وضع أكثر من غاز ) لا تتفاعل كیمیائیاً( في نفس الوعاء یكون الضغط الممارس من قبل كل غاز في المزیج نفسi كما لو كان ھو الغاز الوحید في الوعاء. والضغط الممارس من قبل كل غاز في المزیج یدعى الضغط Partial Pressure
فلو كان لدينا غازات (A, B, C) ، عدد
مولاتها (nA,
nB ,nC) فإن ضغوطها الجزئية تحسب كمايلي:
مولاتها (nA,
nB ,nC) فإن ضغوطها الجزئية تحسب كمايلي:
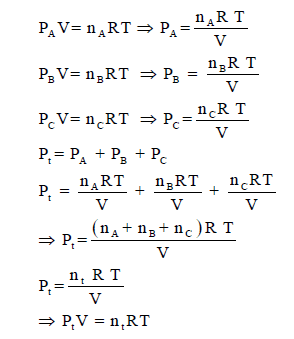
ومن ھنا فإن المعادلة العامة للغازات في صورتھا العامة في حالة الغازات النقیة :
PV = nRT
یمكن تطبیقھا على مخلوط من الغازات تماماً :
PV = ntRT
ولتطبیق قانون دالتون في كثیر من المسائل العملیة فإننا نشتق ما یسمى بالكسر الضغطي Pressure Fraction وھو نسبة الضغط الجزئي لأي مكون من مكونات المخلوط إلى الضغط الكلي:
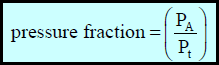
ویمكن أن یحسب لأي غاز بقسمة معادلة الغاز المثالي في الحالة النقية على معادلة الغاز المثالي في حالة مخلوط الغازات :

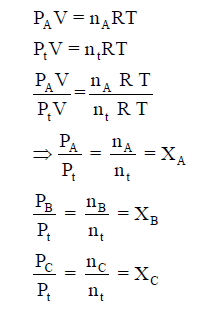
حيث XA, XB, XC هي الكسور المولية Mole Fraction للغازات A, B, C ، ومجموع الكسور المولية = 1
ΣX =
1
1
ویمكن حساب الضغط الجزئي لأي مكون من مكونات المخلوط كما یلي :
PA = XAPt
PB = XBPt
PC = XCPt
حيود
قانون دالتون للضغوط الجزئية
** تتبع معظم مخالیط الغازات البسیطة قانون دالتون تحت الضغط الجوي ولكن كثیراً منھا یظھر حیوداً ملحوظاً تحت الضغوط العالیة تماماً كما تظھر الغازات الحقیقیة حیوداً عن القانون العام للغازات المثالیة تحت الضغوط العالیة . وسوف یتعاظم الحیود عن قانون الغاز المثالي كلما ازداد الضغط الكلي. ویمكن استعمال القانون السابق مادام الغاز بعیداً عن منطقة التسییل للغازات المكونة للخلیط.
** ولا یعزى ذلك الحیود فقط الى التجاذبات بین جزیئات من نفس النوع، ولكن أیضاً الى تجاذبات بین الأنواع المختلفة من الجزیئات.
**
وعلاوة على ذلك، فإن الفراغ الذي یحتوي الجزیئات في الخلیط یكون مشغولاً جزئیاً بجزیئات من أنواع مختلفة، مما یقلل بذلك الحجم الفعال effective volume للغازات الموجودة، ومع ذلك فإنه عملیاً یمكن استعمال قانون دالتون دون خطأ كبیر وذلك عند ضغوط في نطاق واحد جو، حیث یكون الحیود صغیراً.
المراجع
– أسس الكيمياء العامة والفيزيائية- الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية
وعلاوة على ذلك، فإن الفراغ الذي یحتوي الجزیئات في الخلیط یكون مشغولاً جزئیاً بجزیئات من أنواع مختلفة، مما یقلل بذلك الحجم الفعال effective volume للغازات الموجودة، ومع ذلك فإنه عملیاً یمكن استعمال قانون دالتون دون خطأ كبیر وذلك عند ضغوط في نطاق واحد جو، حیث یكون الحیود صغیراً.
المراجع
– أسس الكيمياء العامة والفيزيائية- الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية
 تعرف على علم الكيمياء
تعرف على علم الكيمياء





